Detoxificacion
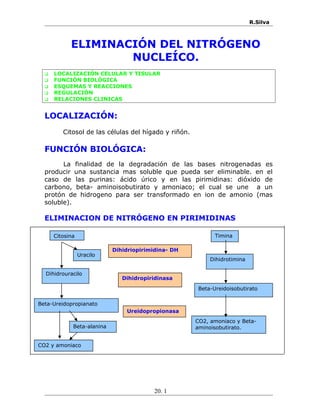
- 1. R.Silva ELIMINACIÓN DEL NITRÓGENO NUCLEÍCO. LOCALIZACIÓN CELULAR Y TISULAR FUNCIÓN BIOLÓGICA ESQUEMAS Y REACCIONES REGULACIÓN RELACIONES CLINICAS LOCALIZACIÓN: Citosol de las células del hígado y riñón. FUNCIÓN BIOLÓGICA: La finalidad de la degradación de las bases nitrogenadas es producir una sustancia mas soluble que pueda ser eliminable. en el caso de las purinas: ácido úrico y en las pirimidinas: dióxido de carbono, beta- aminoisobutirato y amoniaco; el cual se une a un protón de hidrogeno para ser transformado en ion de amonio (mas soluble). ELIMINACION DE NITRÓGENO EN PIRIMIDINAS 20. 1 Citosina Uracilo Dihidrouracilo Beta-Ureidopropianato Beta-alanina CO2 y amoniaco Timina Dihidrotimina Beta-Ureidoisobutirato CO2, amoniaco y Beta- aminoisobutirato. Dihidriopirimidina- DH Dihidropiridinasa Ureidopropionasa
- 2. R.Silva REACCIONES N N O NH2 N H NH O O N NH O O H H H H O C H2 N N H CH2 CH2 COO NH3 NADPH + H NADP H2O H2O - + + - O2 CH3COO + H3N -CH2-CH2-COO CO2 +NH3 1/2 - Citosina Uracilo Dihidrouracilo B-Ureidopropionato O2 B-Alanina Dihidropirimidina-DH Dihidropirimidinasa Ureidopropionasa N H NH O O CH3 N NH O O H H CH3 H O C H2 N N H CH2 C COO CH3 H NADPH + H + NADP + H2O - H2O -+ H3N -CH2-CH-COO CH3CO2 +NH3 Timina Dihidrotimina B-Ureidoisobutirato B-Aminoisobutirato Dihidropirimidina-DH Dihidropirimidinasa Ureidopropionasa Las pirimidinas son transformadas en dioxido de carbono, ion amonio y beta- aminoisobutirato mediante las siguientes reacciones: I. La citosina (uracilo) y timina se convierte en dihidrouracilo y dihidrotimina, esta reaccion es catalizada por la dihidropirimidina-dh permitiendo la oxidacion del nadph. II. Los anillos de el dihidrouracilo y dihidrotimina se abren por hidrólisis obteniendo beta- ureidopropionato y beta- ureisobutirato, esta reaccion es catalizada por la enzima dihidropirimidinasa. III. Por medio de la ureidopropionasa el beta- ureidopropionato se transforma a beta- alanina; y el beta-ureisobutirato en beta- aminoisobutirato. IV. Se eliminan los grupos carbónilos en forma de amoníaco y dióxido de carbono. 20. 2
- 3. R.Silva ELIMINACIÓN DE NITRÓGENO EN PURINAS REACCIONES 20. 3 Adenosina Inosina Guanosina GuaninaHipoxantina Xantina Acido Urico Adenosinadesaminas a Nucleosido de purina fosforilasa Xantina oxidasa Guanasa Xantina Oxidasa
- 4. R.Silva N CH C O N N C OH CH OH HOH2 C N NH2 H H N CH C O N N C OH CH OH HOH2 C NH O H H NH N N NH O NH N N NH O O NH N NH NH O O O H2O NH4 + P Ribosa 1-fosfato H2O + O2 H2O2 H2O + O2 H2O2 Adenosi na Desami nasa Inosina Nucl eosi do de Pur i na Fosf or i l asa Hipoxantina Xant i na Oxi dasa Xantina Acido Urico Adenosina Xant i na Oxi dasa Las purinas son transformadas en ácido úrico a través de los siguientes intermediarios y reacciones: I. La adenosina se desamina a inosina por la enzima adenosina desaminasa. II. La fosforólisis de los enlaces n-glucosídicos de la inosina y la guanosina, se cataliza por la nuclesido de purina fosforilasa: se libera ribosa 1-fosfato y una base de purina. 20. 4
- 5. R.Silva N CH C O N N C OH CH OH HOH2 C NH O H H NH2 NH N N NH O NH2 NH N N NH O O NH N NH NH O O O P Ribosa 1-fosfato Nucleosido de Purina Fosforilasa i Guanina H3N H2O + O2 H2O2 Xantina Acido Urico Xantina Oxidasa Guanosina III. La hipoxantina y guanina forman la xantina, las reacciones son catalizadas por las: xantina oxidasa y la guanasa. IV. La xantina formada se oxida a ácido úrico catalizada por la xantina oxidasa. 20. 5
- 6. R.Silva REGULACIÓN: La regulación del proceso de eliminación del nitrógeno nucleico se da a nivel de sustrato por lo tanto depende de la cantidad de sustrato disponible. Todos los seres humanos son capaces de sitentizar sus propios ácidos núcliecos, de los cuales una parte es integrada y otra eliminada en forma de acido urico, dióxido de carbono, amoniaco y beta- aminoisobutirato. RELACIONES CLÍNICAS: Gota: es una enfermedad asociada con un error congénito del metabolismo del ácido úrico que se caracteriza por el aumento de su producción o la disminución de su excreción. El exceso de ácido úrico se convierte en cristales de urato sódico que se precipitan y se depositan en las articulaciones y otros tejidos. La afección es más frecuente en los hombres que en las mujeres. Una localización frecuente donde se acumulan cristales de urato es el primer dedo del pie. Esta enfermedad puede producir hinchazón articular extraordinariamente dolorosa acompañada de escalofríos y fiebre. Síndrome de Lesch Nyhan: Hiperucemia por sobre producción de liatisis frecuente de ácido úrico y un síndrome raro de automutilación de hipoxantina guanina fosforribosil transferasa no funcional, una enzima de salvamento. la elevacion de prpp intracelular han conducido a la sobreproduccion de purinas. Aciduría Orótica I: Refleja una deficiencia de orotato fosforribosiltrasferasa y orotidilatodescarbosilaso. Aciduría Orótica II: Deficiencia de la orotidilato descarbosilaso, los pacientes de ambos casos responden a la uridina oral siguiendo un notable incremento en la actividad del aspartato transcarbomoilasa e dihidrorotasa. 21. 1
- 7. R.Silva ELIMINACIÓN DE NITRÓGENO PROTEÍCO DEFINICIÓN LOCALIZACIÓN CELULAR Y TISULAR FUNCIÓN BIOLÓGICA ESQUEMA INTEGRACIÓN REGULACIÓN RELACIONES CLÍNICAS DEFINICIÓN: Es un mecanismo consistente en la pérdida del nitrógeno proteico en forma de amonio por medio de la urea, que consta de tres etapas: transaminación, desaminación oxidativa y ciclo de la urea. LOCALIZACIÓN CELULAR Y TISULAR: Transaminación: Citosol y mitocondrias de las celulas hepáticas. Desaminación oxidativa: Citosol de las celulas hepáticas. Ciclo de la urea: Parte de las reacciones son mitrocondriales y las restantes son citosolicas. FUNCIÓN BIOLÓGICA Transaminación: Recoger los grupos amino de los diversos aminoácidos en forma de un solo alfa aminoácido, particularmente el acido glutámico. Desaminación oxidativa: Liberar el grupo amino captado por rl glutamato para que sea incorporado al ciclo de la urea. Ciclo de la urea: Eliminación del amonio toxico, en forma de urea, compuesto hidrosoluble no toxico. 21. 2
- 9. R.Silva DIGESTIÓN DE LAS PROTEINAS: Las proteinas de la dieta, antes de incorporarse a las rutas catabólicas, experimentan hidrólisis hasta transformarse en aminoácidos, ya que estos son absorbidos fácilmente por la membrana celular. Las proteinas son hidrolizadas por acción de las enzimas proteoliticas y peptidasas en el tracto intestinal. A excepcion de las peptidasas intestinales, todas las enzimas proteoliticas son activadas por conversión de cimógenos, precursores proteicos grandes e inactivos. El primer cimógeno que entra en accion es el pepsinógeno que se produce en las células de la pared del estómago. Este cimógeno secretado, es activado de forma autocatalítica por el bajo pH del contenido del estomágo. en condiciones acidas del estomago, el pepsinógeno se convierte en pepsina y en péptidos inertes. Las pepsinas producidas activan la conversión del resto de las moléculas de pepsinógeno en pepsina. La hormona gástrica, secretada por el estómago desempeña un papel importante en el proceso anterior, pues actua como un disparador de la secreción de pepsina. El jugo pancreático tambien contiene cimógenos como:quimiotripsina, tripsinógeno, proelastasa y procarboxipeptidasa. Estas enzimas proteolíticas tienen una notable especificidad para romper las cadenas protéicas en determinadas localizaciones de aminoácidos. Por ejemplo: LOCALIZACION TRIPSINA INTESTINO QUIMIOTRIPSINA INTESTINO PEPSINA ESTÓMAGO Por acción combinada de todas estas enzimas, segregadas por el páncreas, estomago e intestino delgado, las proteínas ingeridas se hidrolizan por completo a aminoácidos, luego son estos son enviados a todos los tejidos por medio de la sangre. Al entrar nuevamente en células individuales se incorporan a los canales metabólicos por un proceso de transporte que requiere energía. 21. 4
- 10. R.Silva 1) Transaminación oxidativa: Consiste en la separacion enzimatica del grupo alfaamino de un alfa- oxocacido (piruvato, alfa-cetoglutamato o el oxalcetato) siendo este transferido al atomo de carbono alfa de otro alfa-oxocacido diferente, dando lugar a la aminacion del alfa-oxoacido aceptor para formar el alfa-aminoacido. Esta reaccion es catabolozada por las transaminasas (glutamato transaminasa o alanin-transaminasa. 2) Desaminación oxidativa: El l-glutamato (alfa-oxoacido) experimenta una desaminacion oxidativa rapida, catabolizada por la glutamato-deshidrogenasa ligada a la piridina, descargando en forma de iones de amonio los grupos aminos, recogidos de las demas aminoacidos. Con este proceso de desaminacion podemos concluir la degradacion de los diferentes aminoacidos para transformarse en los productos desaminados, que puedan ser incorporados al ciclo del acido tricarboxilico. NH2 C O O P O O O CO2 + NH3 + 2ATP + H2O + 2ADP + Pi Fosfato de carbamilo 3) Ciclo de la urea: 1.Síntesis de carbamil fosfato. El amoniaco libre es utilizado junto con el dióxido de carbono para formar fosfato de carbamilo. NH2 NH2CH2CH2CH2CHCOOH C NHCH2 O NH2 C O NH2 NH2 NH2CH2CH2CH2COOH + H3PO4 Fosfato de carbamilo Ornitina Citrulina + 2. Síntesis de la citrulina. El fosfato del carbamilo sede su grupo carbomilo a la ornitina, formando citrulina. C O NH2 NH2 NHCH2CH2CH2CHCOH NH2 HCOCH2CHCOOH C NH C COOH CH2 COOH NH2 H HN NHCH2CH2CH2CHCOOH +AMP +PPi Citrulina Acido aspartico Acido argeninosuccinico + + ATP 3. Síntesis de argininosuccinato. El grupo amino del aspartato se condesa con el atomo de carbono carbolinico. Esta reacción requiere de ATP. 21. 5
- 11. R.Silva C NH C COOHH CH2 COOH NH2 HN NHCH2CH2CH2CHCOOH C NH NH2 NH2 NHCH2CH2CH2CHCOOH CCOOH H H HOOCC Acido argeninosuccinico Arginina Acido fumarico + 4.Desdoblamiento del argininosuccinato en arginina y fumarato. El argininosuccinato forma arginina y fumarato por transeliminación. C NH NH2 NH2 NHCH2CH2CH2CHCOOH NH2 NH2CH2CH2CH2CHCOOH C NH2 O NH2 Arginina Urea+ 5. Desdoblamiento de arginina en ornitina y urea. Esta reacción completa el ciclo de la urea y regenera ornitina. Este desdoblamiento es catalizado por la arginasa. El mecanismo mas importante para la destoxificacion de amoniaco en el tejido cerebral, es la formacion de glutamina. La fijacion de CO2 a los aminoacidos se lleva a cabo en el tejido cerebral. despues de la infusion de amoniaco, los intermediarios del ciclo de Krebs se desvian hacia la sintesis de alfa-cetoglutarato y subsecuentemente de glutamina. 21. 6
- 12. R.Silva INTEGRACION: 21.6 Proteinas Hidroxiprolina Serina, Cisteina, Treonina, Glicina Acetil Co A Aspartato Arginasa Arginosuccinasa Arginosucc.sintasa Carbamoilfosfatosintasa I Carbamil-P sintetasa Transaminasas Exopeptidasa Aminoacidos (Hígado) Alanina Alfa-kg Piruvato Glutamato OA Lactato Endopeptidasa UREA NH3 Arginina Ornitina H+ NH4 CO2 FumaratoC. Krebs Arginosucci. NH4 + CO2 Citrulina Carbamil P ATP ATPATP + P C.Krebs Transaminasas
- 13. R.Silva REGULACIÓN DE LA SÍNTESIS DE UREA: Los tejidos humanos contienen dos formas de carbamoil fosfato sintasa: carbamoil fostato sintasa tipo I y tipo II. La carbamoil fosfato sintasa I es la enzima mitocondrial hepática, limitante de la velocidad del ciclo de la urea. Esta enzima reguladora se activa solo en presencia del modulador alostérico n-acetilglutamato, cuya unión induce un cambio conformacional que aumenta la afinidad de la sintasa por el ATP. La glutamato deshidrogenasa es una enzima omnipresente de los tejidos, que emplea NAD+ o NADP+ como oxidante. La conversión total de los grupos alfa amino a amoniaco requiere de su acción. Su actividad se regula por los inhibidores alostéricos ATP, GTP , NADH y por el activador ADP. La accion conjunta de la glutamato deshidrogenasa y de la carbamoil fosfato sintasa I, incorpora el nitrógeno al carbamoil fosfato, un alto potencial para transferencia de grupos. RELACIONES CLÍNICAS: Hiperamonemia: Esta asociada con anormalidades hereditarias de las enzimas del ciclo de la urea. Existen dos tipos de hiperamonemia: Hiperamonemia congénita tipo I: El defecto enzimático reside en la carbamoil fosfato sintasa. Hiperamonemia congénita tipo II: Consiste en una deficiencia de la ornitin transcarbamilasa. los metabolitos de la pirimidina aparecen en la orina. Los síntomas clínicos de esta patología incluyen: - Vómito - Rechazo hacia los alimentos con alto contenido protéico - Ataxia intermitente - Irritabilidad - Letargia - Retraso mental. 22. 8
- 14. R.Silva MECANISMOS DE DETOXIFICACIÓN HEPÁTICA DEFNICIÓN LOCALIZACIÓN REACCIONES IMPORTANCIA BIOLÓGICA REGULACIÓN RELACIÓN CLÍNICA DEFINICIÓN: Los mecanismos de detoxificación del hígado constituyen una serie de reacciones dirigidas a la eliminación de compuestos ajenos o "extraños" a nuestro cuerpo ("xenobióticos") así como de sustancias de descho que ya no pueden ser metabolizadas. Dentro de los xenobióticos se encuentran sustancias que son excretadas sin sufrir cambio alguno (sin ser metabolizadas). LOCALIZACIÓN: La mayor parte de las reacciones de detoxificación se llevan a cabo en vesículas del retículo endoplásmico liso del hepatocito llamadas "microsomas". Otras tienen lugar en la matriz mitocondrial y en el citosol. REACCIONES: Básicamente hay dos tipos de reacciones: las de fase I y las de fase II. Ambos tipos están encaminados a incrementar la polaridad y por ende la solubilidad en agua de los compuestos metabolizados. Cabe recalcar que algunos compuestos son metabolizados por ambos tipos de reacciones. 22. 9 Metabolito del Fármaco con actividad modificada Metabolito del Fármaco inactivo ABSORCION METABOLISMO ELIMINACION (HIGADO) Farmaco Fase I Fase II Conjugado Conjugado Farmaco Farmaco
- 15. R.Silva REACCIONES DE FASE I Consisten en la modificación de un grupo funcional (oxidación de un alcohol a un aldehído) o introducción de un grupo polar. Algunas de estas reacciones son catalizadas por un sistema de enzimas conocido como "citocromo P450", que consiste en dos proteínas: una NADPH citocromo P450 reductasa y un citocromo P450. Cada una de las reacciones catalizadas por este sistema procede de la siguiente forma: RH + O2 + NADPH + H+ R–OH + H2O + NADP RH puede representar una variedad extensa de fármacos, carcinógenos, contaminantes ambientales y ciertos compuestos endógenos como steroides. 1. El sustrato (RH) se une al citocromo P45o oxidado (P450-Fe3+) para formar un complejo binario. 2. El NADPH se une a la NADPH citocromo P450 reductasa y es oxidado a NADP. Al aceptar el electrón del NADPH la enzima reductasa es reducida. Luego ésta transfiere el electrón al complejo citocromo P450-sustrato para reducirlo (RH-P450-Fe2+). 3. Se introduce un segundo electrón procedente del NAPH a través de la misma enzima reductasa, lo que permite reducir el oxígeno molecular. éste una vez reducido, se une al complejo RH-P450-Fe2+. 4. De esta forma el oxígeno se convierte en el último aceptor de electrones puesto que: - Un átomo de oxígeno se une a dos H+ (que fueron donados por el NADPH) para formar agua (H2O). - El otro átomo de oxígeno se une al sustrato para formar el producto oxidado. - El citocromo P450 es reoxidado 22. 10
- 16. R.Silva El sistema citocromo P450 cataliza las siguientes reacciones: TIPO DE REACCIÓN FÓRMULA SUSTRATO FARMACOLÓGICO Hidroxilación de cadenas alifáticas RCH2CH3 RCH2CH2OH Pentobarbital, amobarbital, secobarbital, clorpropamida, ibuprofeno, meprobamagato, glutetimida, fenilbutazona, digitoxina. 22. 11
- 17. R.Silva TIPO DE REACCIÓN FÓRMULA SUSTRATO FARMACOLÓGICO Hidroxilación de cadenas aromáticas R R OH Acetanilida ,propanolol, fenobarnital, fenitoína, fenilbutazona, anfetaminas, warfarina, 17 α-etinil estradiol, naftaleno, benzopireno. Epoxidación RCH CHR R C C R O HH Aldrin DESALQUILACIÓN OXIDATIVA N-desalquila-ción RNHCH3 RNH2 + CH2O Aminopirina, morfina, etilmorfina, benzfetamina, cafeína, teofilina. O-desalquila-ción ROCH3 ROH + CH2O Codeína, P-nitroanisol S-desalquila-ción RSCH3 RSH + CH2O 6-metiltiopurina, metitural. N-OXIDACIÓN Minas secundarias R1 R1 NH R2 N OH R2 2-acetilamino-fluoreno, acetaminofeno Minas terciarias R1 NR2 NR2 R1 O R3 R3 Nicotina, metacualona. S-OXIDACIÓN (FORMACIÓN DE AULFÓXIDOS). R1 R2 S R2 S R1 O Tioridacina, cimetidina, clorpromacina. DESAMINACIÓN OXIDATIVA R CH3 OH R CCH3RCHCH3 C NH2 NH2 + NH3 O Anfetamina, diacepam SULFURACIÓN C R2 S C O R2 R1 R1 Tiopental DESCLORINACIÓN CCl4 [CCl3] CHCl3 Tetracloruro de carbono 22. 12
- 18. R.Silva Otras reacciones que no son catalizadas por el sistema citocromo P450 son catalizadas por enzimas mitocondriales. Por tanto estas reacciones ocurren en la matriz mitocondrial y no en el retículo en dolplásmico liso. Consisten en la hidrólisis de ésteres y amidas, en la reducción de grupos azo (–N–N–) y nitro (–NO2) y en la oxidación de ciertos aldehídos y alcoholes (como el etanol) catalizada por enzimas deshidrogenasas no específicas. Las reacciones no catalizadas por el sistema citocromo P450 son: TIPO DE REACCIÓN FÓRMULA SUSTRATO FARMACOLÓGICO OXIDACIONES Flavin monooxigena-sa (enzima de ziegler) R3N R3H+ O- R3N+OH H+ Clorpromacina, amitriptilina, benzofetamina Flavin monooxigena-sa (enzima de ziegler) H CH2R N OH CH2 R RCH N CH2 R O RCH2N RCH2 Desipramina, nortriptilina SH N SOH N N N SO2H N N Metimazol, propiltiouracilo Aminooxida-ciones RCH2 NH2 RCHO + NH3 Feniletilamina, Adrenalina. Deshidroge- naciones RCH2OH RCHO Etanol REDUCCIONES Azo RN NR1 RNH NHR1 RNH2 + R1NH2 Prontosil, tartracina. Nitro RNO2 RNO RNHOH RNH2 Nitrobenceno, cloranfenicol, cloracepam, dantroleno. Carbonilo RCR´ O RCHR´ H Metirapona, metadona, naloxona. HIDRÓLISIS Ésteres R1COOR2 R1COOH R2OH Procaína, succinilcolina, aspirina, dlofibrato, 22. 13
- 19. R.Silva metilfenidato. DETOXIFICACIÓN DEL ETANOL El 90% del etanol ingerido es catabolizado por aldehído deshidrogenasas y alcoholes deshidrogenasas no específicas en el citosol del hepatocito. CH3–CH2OH + NAD CH3–CHO + NADH + H+ CH3–CHO + NAD CH3–COOH + NADH + H+ Aproximadamente 10 gramos de etanol son oxidados por hora en un individuo de 70kgr. La velocidad de la oxidación del etanol está limitada por la conversión a NAD del NADH producido en dicha oxidación. El acetaldehído producido por el etanol es oxidado rápidamente a Acetil-CoA, con la liberación adicional de NADH. Sin embargo, una pequeña cantidad de etanol se acumula en la sangre (50μm/dl de plasma). La oxidación del etanol libera energía que puede ser conservada en forma de ATP. El NADH generado es reoxidado en las mitocondrias. Asi mismo el ácido acético puede ser también oxidado a CO2 y H2O, liberando energía adicional. por tanto, el etanol es un combustible con un valor calórico de 7cal/gr. Apenas un 10% del etanol ingerido es catabolizado por el sistema de la citocromo P450, que en este particular recibe el nombre de "sistema 22. 14 Alcohol DH Aldehído DH ETANOL ACETALDEHÍDO ÁCIDO ACÉTICOACETALDEHÍDO
- 20. R.Silva oxidativo microsómico del etanol" (SOME). El some utiliza NADP en lugar de nad como cofactor . Cuando se consumen grandes cantidades de etanol el sistema alcohol deshidrogena se satura debido al agotamiento del cofactor requerido (NAD). conforme aumenta la concentración de etanol hasta 100mg/dl existe un incremento en la actividad del SOME. Efecto paradójico del Etanol: Este efecto consiste en una alta susceptibilidad a los efectos de las drogas (fármacos) mientras se está ingiriendo alcohol, pero resistencia a las misma droga tan pronto como el etanol es completamente metabolizado. Esto se debe a que el etanol mientras está presente en el organismo (sobre todo en grandes concentraciones) inhibe la oxidación de drogas por el citocromo P450, pero a la vez estimula la síntesis de esta enzima. Se cree que esta estimulación es ejercida mediante la fijación del etanol a un receptor citoplasmático: una vez que se forma el complejo inductor-receptor se da la translocación del mismo al interior del núcleo, a fin de que se aumente la transcripción y la traducción de la porción del ADN codificadora del sistema de la enzima citocromo P450. De esta manera, una vez que el etanol deja de estar presente en el organismo, cesa el efecto inhibidor y por ende, la citocromo P450 comienza a catabolizar a dicho fármaco a una mayor velocidad. Cuando los metabolitos de la fase I son los suficientemente polares pueden excretadas con facilidad. Sin embargo, muchos productos de la fase I no se eliminan con rapidez y por tanto debe experimentar una reacción de fase II. REACCIONES DE FASE II Consisten en reacciones de conjugación del compuesto que se va a detoxificar con una sustancia endógena, mediante la adición de un grupo funcional, a fin de formar un conjugado altamente polar e inactivo. En la formación de conjugados participamn intermediarios de alta energía y enzimas de transferencia específicas. Dichas enzimas catalizan el acoplamiento de una sustancia endógena activada con un fármaco, o de un fármaco activado con un sustrato endógeno. Como los sustratos endógenos provienen de los alimentos, la nutrición desempeña un 22. 15
- 21. R.Silva cometido importante en la regulación de las conjugaciones de los fármacos. Los principales sustratos endógenos son compuestos hidrofílicos como: ácido glucurónido, sulfatoo y glutatión. Las reacciones de conjugación siguen el siguiente esquema: Aceptor + DonadorX AceptorX + donador Existen por los menos 5 tipos de reacciones de fase II: - Glucuronidación: el ácido glucurónico-UDP es el donador glucuronilo. esta es la reacción de conjugación más frecuente. - Sulfatación: el donador sulfato es el 3´-fosfato-5´ fosfosulfato de adenosina, que se conoce como sulfato activo. - Conjugación con glutatión: el glutatión es un tripéptido que consiste en ácido glutámico, cisteína y glicina. - Acetilación: la acetil-Coa es el donador de acetilo. - Metilación: emplean s-adenosilmetionina como donador del grupo metilo. Las reacciones de fase II son: TIPO DE CONJUGACIÓN REACTIVO ENDÓGENO TRANSFERASA (LOCALIZA- CIÓN) TIPOS DE SUSTRATOS EJEMPLOS GLUCURONIDACI ÓN UDP, Ácido glucurónico. UDP-glucuro-nosil trans-ferasa (microsomas) Fenoles, alcoholes, ácidos carboxílicos, hibroxilami-nas, sulfona-midas Nitrofenol, morfina, ace-taminofeno, diacepam, N-hidroxidap-sona, sulfa-tiazol, me- probamato, digitoxina, digoxina. , bilirrubina CONJUGACIÓN CON SULFATO Fosfosulfato de fosfoade-nosilo Sulfotransferasa (citosol) Fenoles, alcoholes, aminas aromáticas Estrona, ani-lina, fenol, 3-hidroxico- umarina, ace- taminofeno, metildopa, bilirrubina. CONJUGACIÓN CON GLUTATIÓN Glutatión GSH-S trans-ferasa (cito-sol, microso- mas) Epóxidos, óxidos de areno, gru-pos nitro, hidroxilami- nas Ácido etacrínico, bromobence-no. ACETILACIÓN ACETIL- CoA N-acetiltrans-ferasa (cito-sol) Aminas Sulfonami- das, isoniaci-da, clonacepam, dapsona, mezcalina. METILACIÓN S-adenosilme- tionina Transmetila-sas (citosol) Catecolami-nas, fenoles, aminas, Dopamina, adrenalina, piridina, 22. 16
- 22. R.Silva hista-mina histamina, tiouracilo. CONJUGACIÓN CON GLICINA Glicina Acil-CoA glicina transferasa (mitocon-drias) Derivados Acil-CoA de ácidos carboxóli- cos ácidos salicílico, ácido benzoi-co, ácido nicotínico, ácido cinamí-co, ácido cólico, ácido desoxicólico. CONJUGACIÓN CON AGUA Agua Epóxido hidrolasa (microsomas) Óxidos de areno, oxiranos cis- disustituidos, y monosusti-tuidos. 7,8-epóxido de benzopireno, 1,2- óxido de estireno, epóxido de carba- macepina. CONJUGACIÓN CON AGUA Agua (citosol) Óxidos de alqueno, époxidos de ácidos grasos. Leucotrieno A4 DETOXIFICACIÓN DE LA BILIRRUBINA La conjugación de la bilirrrubina es un ejemplo de reacción de fase II, que se da mediante la adición de moléculas de ácido glucurónico o bien de sulfato en el retículo enplásmico liso del hepatocito. La reacción es catalizada por la glucuronosil transferasa. y utiliza ácido UDP-glucurónico como donador de glucuronosilo. La actividad de la enzima puede inducirse mediante diversos fármacos útiles en la clínica, entre los cuales se incluye el fenobarbital. La mayor parte de la bilirrubina excretada en la bilis está en forma de diglucurónido de bilirrubina METABOLISMO DE FÁRMACOS A PRODUCTOS TÓXICOS Varias sustancias se transforman metabólicamente en intermediarios reactivos, que resultan tóxicos para diversos órganos. Estas reacciones tóxicas se incrementan cuando los mecanismos 22. 17 UDP-glucuronosil transferasa Ácido UDP-glucurónico + Bilirrubina Bilirrubina monoglucurónido + UDP Ácido UDP-glucurónico + Bilirrubina Monoglucurónico UDP-glucuronosil transferasa Bilirrubina dioglucurónido + UDP
- 23. R.Silva de detoxificación están saturados y la disponibilidad de cosustratos detoxificantes endógenos (en el caso de las reaecciones de fase II) está limitada. En estas circunstancias se activa la vía tóxica y da como resultado la toxicidad declarada para los órganos (carciogénesis). Un ejemplo de intoxificación inducida es el del acetaminofeno. por lo general este fármaco experimenta glucuronidación y sulfatación hasta los conjugados correspondientes, que forman en conjunto 95% de los metabolitos totales que se excretan. Una vía de conjugación alternativa del glutatión dependiente de citocromo P450 metaboliza el restante. Cuando el consumo excede en forma considerable las dosis terapéuticas, las vías de glucuronidación y sulfatación se saturan y la vía metabólica dependiente del citocromo P450 adquiere mayor importancia. no se observa hepatotoxicidad o sólo se presenta a concentraciones bajas mientras haya glutatión disponible para la conjugación. Sin embargo con el transcurso del tiempo el glutatión hepático se agota más rápido de lo que se regenera con lo que se acumula un metabolito reactivo y tóxico. A falta de nucleófilos intracelulares como el glutatión, este metabolito reactivo (que se piensa es un producto n-hidroxilado o una n-acetilbenzoiminoquinona) reacciona con otros grupos nucleófilos presentes en las macromoléculas celulares, como las proteínas, y da como resultado hepatotoxicidad. 22. 18 Ac. Glucurónico Ac. SulfatoAcetaminofeno Ac. Mercapturato GS-AC Compuesto Electrofílico Reactivo (AC) AC-Proteína GSH Proteína Muerte celular hepática Citocromo P450
- 24. R.Silva (AC: intermediario reactivo; GS: porción del glutatión ) IMPORTANCIA BIOLÓGICA: Las reacciones de fase i y fase ii permiten incrementar la polaridad y por ende la solubilidad en la sangre y en la orina de los compuestos extraños a nuestro organismo, a fin de facilitar su excreción. Todas estas reacciones tienen un amplio espectro de acción, ya que muchos xenobióticos pueden ser catabolizados por distintas vías (ya sea por reacciones de fase I o de fase II). De esta manera se evita que se acumulen en nuestro cuerpo. Por otra parte, los mecanismo de detoxificación actúan como un sistema de defensa importante en contra de ciertos compuestos tóxicos como algunos fármacos o carcinógenos. Por ejemplo, si xenobióticos con potencial tóxico no fueran conjugados con el glutatión, quedarían libres para combinarse por covalencia con ADN, ARN o proteína celular y así causar daño grave a las células. 22. 19 GSH–S TRANSFERASA O EPÓXIDO HIDROLASA Xenobiótico Metabolito reactivo Metabolito no tóxico CIT. P450 Fijación covalente a macromoléculas Hapteno MutaciónLesión celular Producción de anticuerpo Lesión celular
- 25. R.Silva REGULACIÓN: Varios factores modifican las actividades de las enzimas que metabolizan xenobióticos: 1. Especie del organismo 2. Factores genéticos Los factores genéticos que influyen en los valores de las enzimas explican las diferencias individuales en la velocidad el metabolismo. Por ejemplo, succinilcolina es metabolizada sólo a la mitad de su velocidad en personas con defectos determinados por genes, en su seudocolinesterasa en relación con personas que tienen funciones normales. Una situación semejante sucede en la acetilación de isoniacidas, donde el efecto de los acetiladores lentos, de isoniacidas y aminas semejantes, es causada por síntesis escasa de la enzima y no por la formación anormal de ésta. Este defecto es heredado con carácter recesivo autosómico. 3. Edad y Sexo Existe un aumento en la sensibilidad a la actividad farmacológica o tóxica de los fármacos en pacientes muy jóvenes, posiblemente a diferencias de absorción, distribución, eliminación y metabolismo de los fármacos. Algunos informes clínicos indican que en el hombre existen variaciones en el metabolismo de los fármacos, dependientes del sexo, en el metabolismo de benzodiacepinas, estrógenos y salicilatos. 4. Factores ambientales Contribuyen a variaciones individuales en el metabolismo de los fármacos. por ejemplo, los fumadores y trabajadores industriales expuestos a algunos plaguicidas metabolizan algunos medicamentos con más rapidez que los no fumadores e individuos no expuestos respectivamente, debido a la inducción enzimática ejercida por el humo del tabaco y los plaguicidas. 5. Ingestión de varios xenobióticos que actúan como inductores 6. Metabolitos de ciertos xenobióticos que actúan como inhibidores. Inductores En el caso del citocromo P450, la administración repetitiva de muchos de los compuestos metabolizados por este sistema puede 22. 20
- 26. R.Silva inducir la síntesis de las dos enzimas que componen a dicho sistema, o bien puede reducir la velocidad de su degradación. La inducción da como resultado una aceleración del metabolismo y, en general una reducción de la actividad farmacológica del inductor y también de los fármacos que se administran de manera simultánea con él. sin embargo, en el caso de fármacos que sufren transformación metabólica dando origen a metabolitos reactivos, la inducción enzimática puede aumentar la toxicidad del fármaco para los tejidos. FORMA DE CITO- CROMO P450 SUSTRATOS INDUCTORES 1 A 2 Acetamino-feno Antipirina Cafeína Clomipra-mina Fenacetina Tamoxifeno Teofilina Warfarina Humo de tabaco Alimentos asados al carbón Vegetales de la familia de las crucíferas 2 A 6 Cumarina Ninguna 2 C 9 Fenitoína Hexobarbi-tal Ibuprofeno S-warfari-na Trimetadio-na Tolbutami-da Barbituratos, rifampina 2 C 19 Diacepam Naproxeno Omeprazol Proprano-lol S-mefentoí-na Ninguno 2 D 6 Amitriptili-na Clomiprami-na Clozapina Codeína Debrisoqui-na Desipramina Dextrome-torfano Encainida Esparteína Fenformina Flecainida Fluoxetina Guanoxán Haloperidol Hidrocodo-na Imipramina Metropolol 4-metoxián- fetamina Mexiletina Nortriptili-na Oxicodona Paroxetina Propafenona Propoxifeno Selegilina Tioridazina Timolol Ninguno 2 E 1 Acetamino-feno Clorzoxazo-na Enflurano Halotano Etanol (una vía menor) Ninguno 22. 21
- 27. R.Silva 3 A 4 Acetamino-feno Alfentanil Amiodarona Astemizol Ciclosporina Cocaína Cortisol Dapsona Diacepam Dihidroer- gotamina Diltiacém Eritromicina Etinil estra-diol Felodipina Gestodeno Lidocaína Lovastatina Miconazol Midazolam Nifedipina Niludipina Nitrendipina Palitaxel Progestero-na Quinidina Rapamicina Sufentanil Sulfame-toxazol Tacrolimus Tamoxifeno Terfenadina Testostero-na Triazolam Troleando-micina Verapamil Antibióticos macrólidos, barbituratos, glucocorticoides, rifampina. Las enzimas de las reacciones de fase I no catalizadas por citocromo P450 pueden verse estimuladas también por los mismos mecanismos en que lo es éste. Las enzimas que catalizan las reacciones de fase II pueden verse estimuladas cuando hay altas concentraciones de la sustancias endógenas que donan el grupo funcional para conjugar el compuesto a excretar. Es decir, que pueden ser inducidas por las altas concentraciones de: - Ácido glucurónico - Glutatión reducido - Sulfatos Inhibidores Los inhibidores del citocromo P450 pueden ser clasificados en dos tipos generales según el mecanismo de inhibición: 1. Los inhibidores competitivos se fijan con fuerza al hierro HEM del citocromo P450 e inhiben de manera competitiva el metabolismo de sustratos endógenos u otros fármacos administrados de forma simultánea. Entre estos inductores se encuentran los fármacos que contienen imidazol, como cimetidina y cetoconazol. 2. Los inhibidores que inactivan al grupo hem del citocromo P450, le quitan de forma irreversible su actividad catalítica. entre estos fármacos se encuentran los antibióticos macrólidos, como troleandomicina, eritromicina y otros derivados de ésta. Otros inactivadores son: Esteroides etinil estradiol Noretindrona Espironolactona Anestésico fluoroxeno Barbitúrico alobarbital Sedantes analgésicos: Alilisopropilacetilurea, Dietilpentenamida Etclorovinol 22. 22
- 28. Las enzimas que catalizan las reacciones de fase II pueden verse inhibidas por las bajas concentraciones de sustratos endógenos. RELACIÓN CLÍNICA: Al finalizar las dos fases del mecanismo de detoxificación hepática no siempre se da la inactivación de sustancias tóxicas, sino que en ciertas ocasiones varias sustancias se transforman metabólicamente en intermediarios reactivos, que resultan tóxicos para diversos organismos. Muchas veces a partir de la liberación de radicales libres, lo que incluye mutagenicidad (cambio poco habitual en el material genético), teratogenicidad (desarrollo de defectos físicos en el embrión) y carcinogenicidad. Los efectos tóxicos de los xenobióticos conforman un amplio espectro; sin embargo, existen 3 tipos generales de efectos: 1. El primero de éstos es la lesión celular, que puede resultar suficientemente grave y provocar la muerte celular. Un mecanismo para este tipo de daño es la unión covalente de macromoléculas celulares a especies reactivas de xenobióticos producidas por metabolismo. Estos blancos macromoleculares incluyen ADN, ARN y proteínas. Dentro de éstas últimas se encuentran aquellas que se encargan de funciones esenciales como la fosforilación oxidativa y la regulación de la permeabilidad de la membrana. 2. Las especies reactivas derivadas de un xenobiótico pueden unirse a una proteína, alterando su antigenicidad. El xenobiótico actúa entonces como hapteno, es decir, una molécula que por sí sola no estimula la síntesis de anticuerpos, sino que se combina con el anticuerpo una vez formado. Los anticuerpos producidos dan origen entonces a reacciones alérgicas en respuesta al fármaco en cuestión. éstas pueden así dañar la célula mediante varios mecanismos inmunológicos que afectan profundamente los procesos bioquímicos normales. Ejemplos de fármacos que pueden producir reacciones alérgicas son las aspirina y la penicilina. Esta última es un antibiótico que al
- 29. actuar como hapteno, se combina con proteínas del suero o tejidos para formar un antígeno completo que puede presentarse en 3 formas químicas distintas. De esta manera el organismo puede originar anticuerpos contra tres especificidades antigénicas diferentes, cuando menos. Ello plantea la posibilidad de que surja un cuadro clínico anómalo producido por una combinación de tipos distintos de reacciones alérgicas. En algunos casos de anemia hemolítica inducida por penicilina, los antígenos contra este fármaco originan lisis de eritrocitos recubiertos con dicho antibiótico. 3. La reacción entre las especies reactivas derivadas de carcinógenos químicos con el ADN, resulta fundamental en al carcinogénesis química. Algunos compuestos químicos, (por ejemplo, el benzopireno) requieren activación por monooxigenasas para convertirse en carcinógenos (carcinógenos individuales). Otras sustancias (por ejemplo, varios factores alquilantes) pueden reaccionar de manera directa (carcinógenos directo) con ADN. Las reacciones tóxjcas probablemente no sean evidentes a niveles bajos de exposición a los compuestos originales, cuando los mecanismos de detoxificación alternativos todavía no están saturados o afectados, y la disponibilidad de cosustratos detoxificantes endógenos no es limitada. Sin embargo, cuando se agotan estos recursos, la vía tóxica puede prevalecer y dar como resultado toxicidad declarada para la órganos, o carcinogénesis. Un ejemplo es la hepatotoxicidad inducida por el acetaminofeno, un antipirético y analgésico, que a dosis terapéuticas es seguro (1.2 gr./día para el adulto). en condiciones normales, experimenta glucuronidación y sulfatación (reacciones de fase II) hasta los conjugados correspondientes, que forman el 95% de los metabolitos totales que se excretan. una vía de conjugación alternativa del glutatión (GSH) dependiente del citocromo P450 metaboliza el restante. Cuando consumo de acetaminofeno excede en forma considerable las dosis terapéuticas, las vías de glucuronidación y sulfatación se saturan y la vía metabólica de pendiente del citocromo P450 adquiere mayor importancia. Puede haber muy poca o ninguna hepatotoxicidad mientras haya glutatión disponible para la conjugación. sin embargo, con el tiempo, éste se agota más rápido de lo que se genera, acumulando un metabolito reactivo y tóxico. A falta de nucleófilos intracelulares como el glutatión, este metabolito reactivo reacciona con otros productos nucleófilos presentes
- 30. en las macromoléculas celulares como las proteínas y da como resultado hepatotopxicidad y posteriormente la muerte. Por otra parte, algunos de los efectos de la oxidación del etanol en el hígado se citan a continuación. EFECTO METABÓLICO CONSECUENCIA CLÍNICA - Inhibición de gluconeogénesis - Hipoglucemia en pacientes en ayuno - Inhibición de oxidación de ácidos grasos - Hígado graso - Provisión de exceso de carbono para síntesis de ácidos grasos - Hiperlipidemia - Inhibición de la absorción del lactato por el hígado - Acidosis láctica - Incremento de la producción de cuerpos cetónicos - Cetosis media - Incremento en la utilización de oxígeno - Incremento en la susceptibilidad del hígado a anoxia CIRROSIS: La cirrosis producto de la hiperlipidemia es una enfermedad degenerativa crónica del hígado en la que los lóbulos están cubiertos por tejido fibroso; el parénquima se ha degenerado y los lobulillos están infiltrados por grasas. Ante esta patología se ven alterados los mecanismos de detoxificación, produciéndose de este modo acumulación de xenobióticos y derivados activos que pueden ser perjudiciales para el organismo.