Leyes de la Termodinámica.pptx
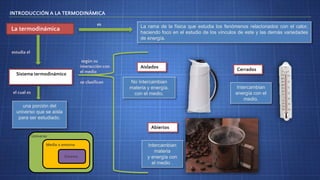
- 1. INTRODUCCIÓN A LA TERMODINÁMICA La termodinámica estudia el es La rama de la física que estudia los fenómenos relacionados con el calor, haciendo foco en el estudio de los vínculos de este y las demás variedades de energía. Sistema termodinámico Universo Medio o entorno Sistema Aislados No Intercambian materia y energía. con el medio. Cerrados Intercambian energía con el medio. Abiertos Intercambian materia y energía con el medio . una porción del universo que se aísla para ser estudiado. se clasifican el cual es según su interacción con el medio
- 2. Therme: calor Dynamis: movimiento (fuerzas) Siglo XVIII:“Estudio de las fuerzas que originan el calor” Estudio de las máquinas de vapor
- 4. Otras definiciones: • Parte de la física que estudia la energía y la entropía. • Ciencia que estudia la relación entre el calor y el trabajo y de aquellas propiedades de las sustancias que guardan relación con ellas.
- 5. LEYES DE LA TERMODINÁMICA
- 8. Sistema termodinámico • Sistema : Porción del universo definida por el observador para llevar a cabo un estudio. Lugar o volumen de control Sistema Observador Energía Energía
- 10. •Alrededores : Es todo aquello que no forma parte del sistema. (lo que rodea al sistema) Universo = Sistema + Alrededor. • Fronteras: Son los límites que define un sistema y pueden ser físicos (reales) o imaginarios; móviles o fijas.
- 13. Volumen de control. • Volumen de control : es un sistema definido cuando esta involucrado un flujo de masa durante su estudio. • Sistema abierto: Es aquel que intercambia materia a través de las fronteras. • Sistema aislado: Es aquel que no percibe influencias del alrededor. Ni el calor ni el trabajo cruzan las fronteras del sistema.
- 14. • Propiedad termodinámica: es una variable que cuantifica la situación de un sistema. Esta depende del estado del sistema y es independiente de la trayectoria (esto es, de sus antecedentes) por la cual haya llegado a dicho estado. • Podemos clasificarlas en: intensivas y Extensivas. • Propiedades intensivas: Aquellas que NO dependen de la masa del sistema. (Ejemplo : presión (P), Temperatura (T), densidad (ρ). • Propiedades extensivas: Aquellas que dependen de la masa del sistema. . (Ejemplo : peso (F = m x g), Volumen (V) Propiedad termodinámica
- 15. ESTADO Estado: es la condición del sistema definida por sus propiedades independientes.
- 16. Procesos. • proceso: es la transformación de un estado a otro, siendo el camino del proceso la serie de estados a través de los cuales pasa. Proceso característica Isotérmico Temperatura constante Isobárico Presión constante isocórico Volumen constante Isentrópico Entropía constante Adiabático Q = 0 , no existe transferencia de calor.
- 17. Ciclo. • Ciclo: es un proceso que comienza y termina en un mismo estado. Las propiedades varían durante el transcurso del ciclo. Pero al volver al estado inicial todas las propiedades vuelven a tomar sus valores originales. • Equilibrio: es cuando en un sistema no ocurren cambios en sus propiedades sin un estímulo externo.
- 18. Fase. • Fase: cantidad homogénea y uniforme de materia. • Sustancia de trabajo: es la materia a considerar dentro del sistema en estudio. Las propiedades termodinámicas dependen de su naturaleza y de las condiciones de operación.
- 19. La termodinámica estudia las propiedades que se conocen como variables termodinámicas (composición y concentración de los componentes, presión, volumen, temperatura), que se refieren al comportamiento global de un número muy elevado de partículas y que definen el llamado estado del sistema. Cuando estas variables tienen un valor definido para cada estado del sistema sin depender de los procesos que este haya experimentado reciben el nombre de funciones de estado.
- 21. TRANSFORMACIONES DE UN SISTEMA TERMODINÁMICO Las transformaciones de un sistema termodinámico desde un estado inicial a otro final pueden tener lugar de distintas formas que se representan gráficamente en un diagrama P-V. γ es el coeficiente adiabático y se calcula: CP/CV
- 22. Primer principio de la termodinámica En el ejemplo, al calentar el agua el tapón sale lanzado. El calor transmitido al agua se transforma en: -Lanzar el tapón (trabajo mecánico) -Aumentar la energía interna de las moléculas de agua
- 25. 2º Principio de la Termodinámica hay muchos enunciados equivalentes de la segunda ley de la termodinámica: (1) Un sistema aislado evoluciona de forma natural hacia las configuraciones más probables. (2) Un sistema aislado evoluciona de forma natural hacia la redistribución de la energía disponible equitativamente entre sus partes. (3) En los sistemas aislados, el calor fluye de los cuerpos calientes a los fríos. (4) La capacidad de un sistema aislado de convertir calor en trabajo decrece constantemente. (5) Aunque la energía se conserva, la energía disponible en cualquier sistema aislado siempre disminuye. (6) Los sistemas aislados evolucionan en el sentido en el que incrementan su entropía (disminuyen su orden).
- 26. Segundo principio de la termodinámica
- 27. Hay que darse cuenta de que la energía calorífica puede utilizarse para elevar una masa y realizar trabajo, sólo porque había una diferencia de temperaturas entre los dos gases. Si inicialmente los gases hubieran estado a la misma temperatura, entonces el sistema habría estado en equilibrio y no habría habido flujo de calor. Podría existir una gran cantidad de energía calorífica presente en ambos gases, en forma de movimientos moleculares, pero la energía no podría utilizarse para realizar trabajo. Si el calor no fluye, el peso no se puede elevar. El caso en el que las dos temperaturas son iguales, produciría el mismo efecto que salir de la ducha y tratar de secarse con una toalla húmeda. Si la toalla está tan húmeda como tú, no te podrás secar. NO EXISTE UNA MÁQUINA CAPAZ DE CONVERTIR EL CALOR EN TRABAJO A EXPENSAS DE UNA SOLA FUENTE
- 28. CONSECUENCIAS A NIVEL GLOBAL Ya que el calor fluye continuamente de los cuerpos calientes a los fríos en todos los lugares del universo, como dice la segunda ley de la termodinámica, el universo pierde gradualmente su capacidad de realizar trabajo. La cantidad total de energía disponible disminuye constantemente. No sólo es que todas las máquinas del universo se estén descargando, sino que además la capacidad de reconvertir el calor resultante en trabajo se reduce con el tiempo. No hay forma de eludir la unidireccionalidad de la segunda ley de la termodinámica. Esta implicación sorprendente de la segunda ley, que ha intrigado y alarmado a la gente desde mediados del siglo xIx, se ha denominado la «muerte térmica» del universo. Aún se debate entre los físicos de qué manera se aplica la segunda ley de la termodinámica al universo como un todo.
- 29. Máquinas térmicas El deseo de construir máquinas tan eficientes como fuera posible fue el motivo de gran parte de la comprensión de la segunda ley. La primera de estas investigaciones la realizó el científico, físico e ingeniero francés Sadi Carnot (memoria clásica «Reflections on the Motive Power of Fire(*)» (1824) )una vez que la revolución industrial estaba a pleno ritmo. En particular, Carnot quería saber la eficiencia teórica máxima de una máquina térmica (dispositivo que puede realizar trabajo movido por calor, llamado motor térmico.) (*)Reflexiones sobre la potencia motriz del fuego y sobre las máquinas adecuadas para desarrollar esta potencia
- 30. Ciclo de CARNOT
- 32. CONCEPTOS BÁSICO DE TERMODINÁMICA Autor: Marcos Lazzarini ENERGÍA (E) : se define como “la capacidad que tiene un cuerpo para realizar trabajo“. TRABAJO (W): En física se define trabajo como “la fuerza que se ejerce sobre un cuerpo para producirle un movimiento, en una determinada distancia” Su fórmula es W (trabajo)= F(fuerza) x d (distancia) Su unidad es el Joule se simboliza con la letra “J” Por lo tanto hablar de trabajo es lo mismo que hablar de energía y viceversa. Entonces cualquier energía se puede expresar en “Joule” TEMPERATURA (T): “Es una medida de la energía cinética promedio de todas las moléculas de un sistema” . ENERGÍA INTERNA (U): “Es la suma de las energías cinéticas y potenciales de todas las moléculas que componen a un sistema”. Energía Interna (U) = Energía cinética (Ec) + Energía potencial (Ep) Hay tres tipos de energía cinética: de traslación, rotación y vibración. Hay diferentes Energía potenciales ( elástica, gravitatoria, eléctrica, química y nuclear). CALOR (Q): “Es energía en transito” entre dos sistemas con diferentes temperatura o “Energía cinética media” ,la dirección del calor siempre es desde el cuerpo que tiene mayor temperatura al de menor temperatura, es decir del cuerpo más caliente al más frío. A este tipo de energía se la conoce como energía térmica o calórica. ¿CON QUÉ UNIDADES DE ENERGÍA SE MIDE EL CALOR? Las unidad de energía es el Julio se simboliza por la letra “J “. El “CALOR” o energía calórica, tiene su equivalente de energía , la “CALORÍA” ,se simboliza ”cal” Se define como “la cantidad de calor que se necesita aportar a un 1 g de agua para que eleve su temperatura en 1°C” 1 CALORÍA = 4,18 Joule , en símbolos 1 cal = 4,18 J Un múltiplo muy utilizado es la kilocaloría 1Kcal = 1000 cal TA > TB A B Q A→B
- 33. ANÁLISIS DE LA RELACIÓN DE CALOR, ENERGÍA INTERNA Y TEMPERATURA Autor: Marcos Lazzarini En el siguiente ejemplo se tiene dos sistemas “A” y ”B” con las siguientes condiciones: ✔ Cada sistema posee sustancias diferentes, gaseosas y monoatómicas. ✔ Los dos sistemas tienen igual masa. ✔ Las moléculas del sistema “A” tienen el doble de tamaño que las moléculas del sistema “B”. ✔ Solo considera solamente la energía cinética de traslación. ✔ El sistema “A” formado por 10 moléculas y el sistema “B” por 20 moléculas. ✔ Se entrega a ambos sistemas 200 J de calor. ✔ Conclusión: A sustancias diferentes de igual masa al entregarle una misma cantidad de calor aumentarán su energía interna en la misma proporción pero tendrán diferentes temperaturas. Q = 200 J Q = 200 J Energía Cinética media 20 J Energía Cinética media 10 J 10 moléculas A B 20 moléculas TA > TB ∆UA = ∆UB MA = MB ∆U B = 20 moléculas x 10 J = 200 J ECm_A < ECm_B ∆U A = 10 moléculas x 20 J = 200 J
- 34. PRINCIPIOS DE LA TERMODINÁMICA “1°Principio de la termodinámica” 0 “Ley de la conservación de energía” Este principio dice que la energía se puede transferir o convertirse de una forma a otra, pero jamás se puede crear o destruir, la energía en el universo es constante. ∆U = Q + W Calor (Q) (+) Energía Interna (U) Trabajo (-) (W) Entorno Sistema Calor (Q) (-) Trabajo (+) (W)
- 35. PRINCIPIOS DE LA TERMODINÁMICA “1°Principio de la termodinámica” 0 “Ley de la conservación de energía” “En un proceso termodinámico, la energía interna de un sistema puede aumentar, disminuir o mantenerse sin cambio. “En todo proceso termodinámico la variación de energía interna depende solamente del estado inicial y final de un sistema”