Enlaces químicos e interacciones intermoleculares.
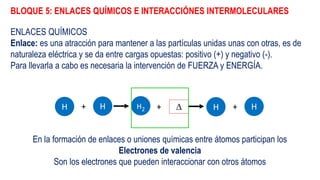
- 1. BLOQUE 5: ENLACES QUÍMICOS E INTERACCIÓNES INTERMOLECULARES ENLACES QUÍMICOS Enlace: es una atracción para mantener a las partículas unidas unas con otras, es de naturaleza eléctrica y se da entre cargas opuestas: positivo (+) y negativo (-). Para llevarla a cabo es necesaria la intervención de FUERZA y ENERGÍA. H H+ H2 + H H+ En la formación de enlaces o uniones químicas entre átomos participan los Electrones de valencia Son los electrones que pueden interaccionar con otros átomos
- 2. ENLACES QUÍMICOS Fuerzas Intramoleculares IONICO COVALENTE Polar No polar METÁLICO Fuerzas Intermoleculares Van der Waals Dipolo - dipolo London Puentes de Hidrógeno
- 3. REGLA DEL OCTETO (Gilbert Newton Lewis, 1916). Participan los electrones de valencia, se trata de una tendencia a completar el nivel de energía externo (s y p) de los átomos involucrados con 8 electrones adquiriendo así la configuración electrónica de un gas noble. PERO, HAY EXCEPCIÓNES - H, que al completar su nivel externo con 2 electrones adquiere la propiedad del He. - Los metales de transición - BF3 - PCl5 - SF6 He Ne Ar Kr Xe Rn 2 10 18 36 54 86
- 4. NIVELES DE ENERGÍA DEL ÁTOMO (Números cuánticos) n I Número cuántico secundario Númerocuánticoprincipal 1s2 7 2s2 3s2 4s2 5s2 6s2 7s2 2p6 3p6 4p6 5p6 6p6 7p6 3d10 4d10 5d10 6d10 4f14 5f14 6f14 0 1 1 2 2 3 3 4 5 6 Número cuántico principal (n) Describe el nivel energético PRINCIPAL de un electrón, sus valores van desde 1 hasta 7 Número cuántico secundario (I) Indica el tipo de ORBITAL en el que se encuentra el átomo. Este valor es variable y determina el tipo de orbital o SUBNIVEL energético del electrón s (nítido), p (principal), d (difuso), f (fundamental) Momento magnético (m) Es la orientación del e- en el espacio bajo la influencia de un campo magnético Spin o giro (s) Indica la orientación del giro del electrón sobre su propio eje.
- 5. PROPIEDADES PERIÓDICAS - + + - ELECTRONEGATIVIDAD Capacidad del núcleo atómico de un elemento para atraer a los electrones de otro átomo.
- 6. He Ne Ar Kr Xe 2 10 18 36 54 CONFIGURACIÓN ELECTRÓNICA DIAGRAMA DE LEWIS e- VALENCIA
- 7. CONFIGURACIÓN ELECTRÓNICA DIAGRAMA DE LEWIS HNO3 Ácido nítrico FORMULA CONDENSADA H3SO4 Ácido Sulfúrico CH4 Metano
- 8. ENLACE IÓNICO. TRANSFERENCIA DE UNO O MÁS ELECTRONES DE UN ÁTOMO A OTRO O GRUPO DE ÁTOMOS→ Ganancia o pérdida de electrones. Metales con no metales. Salino o electrovalente En estado sólido no conducen la electricidad. En solución si. Son redes cristalinas (Cristal geométrico). Puntos de fusión y ebullición elevados
- 9. ENLACE COVALENTE. COMPARTICIÓN de o más pares de electrones entre los átomos que se unen. - NO METALES. - REPULSIÓN DE PARES ELECTRÓNICOS EN CAPAS DE VALENCIA (H2O). COVALENTE POLAR: Cargas parciales (-) y (+), con distribución asimétrica entre los átomos → se crea un dipolo. CLORURO DE HIDRÓGENO HCL AGUA H2O COVALENTE NO POLAR: Dos átomos de un mismo elemento se unen para formar una MOLÉCULA VERDADERA con distribución simétrica (O2, H2).
- 10. ENLACE COVALENTE. COVALENTE COORDINADO: Un átomo de un elemento dona su par de electrones a otro elemento que los acomoda en un orbital vacío H CLORURO DE AMONIO (NH4Cl). N H H H Cl
- 11. ENLACE COVALENTE. Propiedades - Punto de fusión variado. - En estado sólido no condicen electricidad. - En solución son buenos conductores de electricidad. - Existen en sus tres estados de agregación - Se pueden obtener MOLÉCULAS VERDADERAS Y DIATÓMICAS (2 ÁTOMOS)
- 12. CURIOSIDADES DE LOS METALES. Son muy abundantes y la mayoría se encuentran formando compuestos. CAUSAS BENÉFICAS
- 13. CURIOSIDADES DE LOS METALES. Son muy abundantes y la mayoría se encuentran formando compuestos. CAUSAS PERJUDICIALES
- 14. ENLACE METÁLICO. Ocurre entre átomos de metales que tienen pocos electrones (de 1 a 3) en el último nivel de energía. Forman enlaces des-localizados o libres → Ubicación de los electrones y su desplazamiento entre los Cationes metálicos. Aniones → ANODO (-) Cationes → CATODO (+)
- 15. ENLACE METÁLICO. ALEACIONES: Calentamiento de los metales hasta fundirlos. Se crea una aleación por sustitución, es decir la red metálica no se desordena, esto se debe a que la diferencia de tamaño entre átomos no es muy grande. ALEACIÓN INTERSTICIAL: Cuando la diferencia del tamaño entre átomos es mas grande, los átomos de menor tamaño ocupan los espacios de los átomos mayores.
- 16. TIPO DE ENLACE IÓNICO COVALENTE METÁLICO Tipo de elemento En general metal con un no metal Unión de átomos de un mismo elemento no metálico En general se encuentran formado compuestos Punto de fusión Muy alto Variados Elevado Punto de ebullición Muy alto Variados Elevado Conductividad No conducen la electricidad en estado sólido, pero si en una disolución acuosa Malos conductores de calor y electricidad Buenos conductores de calor y electricidad Estructura que se forma Estructuras cristalinas Gases, Líquidos o Sólidos Solidos (Generalmente). Forma redes. Ejemplos de sustancias NaCl, NaF KBr, CaBr2 K2O, CaO MgF2, MgO Gases: Cl2, O2, N2, Co2. Líquidos: H2O, CCl4 Sólidos: C, S Au (oro) Ag (plata)
- 17. FUERZAS INTERMOLECULARES (Interacciones entre moléculas).. FuerzasIntermoleculares Enlaces químicos Iónicos Covalentes Metálicos Interacción de moléculas Estados de agregación Puntos de ebullición Solubilidad
- 18. Van der Waals Atracciones o repulsiones débiles para los gases y más fuertes para sólidos y líquidos Dispersión de London Presentes débilmente en moléculas polares y es dependiente de la cantidad de electrones. Se puede crear un dipolo Dipolo-Dipolo Fuerzas entre dos moléculas con dipolos permanentes. Es similar al enlace iónico. Ejemplo: HCl Dipolo-Dipolo Inducido Es una interacción de moléculas polares. Su intensidad depende del tamaño del ion, su carga eléctrica y la fuerza del dipolo. Fuerzas Intermoleculares FUERZAS INTERMOLECULARES.
- 19. PUENTES DE HIDRÓGENO IMPORTANTE PARA LA VIDA REACCIONES QUÍMICAS, FISIOLOGÍA PUNTOS DE FUSIÓN Y EBULLICIÓN PROTEÍNAS
- 20. BLOQUE 6: NOMENCLATURA QUÍMICA INORGÁNICA Lavoisier → Un lenguaje en caja negra Lenguaje alquimista, un tanto confuso. Necesidad de dar un nombre lógico, descriptivo y pertinente… Con base en los 118 elementos de la tabla periódica.
- 22. J. J Berzelius→ Símbolos modernos para los elementos. Nombres latinos de 1, 2 o 3 letras. IUPAC, International Union of Pure and Applied Chemistri. Simbología universal N = Nitrogeno Ca = Calcio Unq = Unnilquadium DIOSES MITOLÓGICOS CUERPOS CELESTES PAÍSES O CIUDADES PERSONAJES FAMOSOS COLOR CARACTERÍSTICO
- 23. NOMENCALTURA Y ESCRITURA DE FÓRMULAS NOMBRE QUÍMICO NOMBRE COMÚN O COMERCIAL FÓRMULA Carbonato de plomo Cerusita PbCO3 Óxido de zinc Cincita ZnO Sulfato de potasio Sulfato de potasa K2SO4 Cloruro de potasio Muriato de Potasa KCl Sulfato de magnesio Sal de Epsom MgSO4 Nitrato de sodio Nitrato de chile NaNO3
- 24. NÚMERO DE OXIDACIÓN. Es la carga con la cual actúa un átomo del elemento cuando se asignan al átomo más electronegativos los electrones que forman el enlace. Configuración electrónica • Dos o más elementos para formar un COMPUESTO Ganar, perder o compartir electrones • TIPO DE ENLACE • IÓNICO • COVALENTE • METÁLICO NÚMERO DE OXIDACIÓN DEL ÁTOMO • +1 • -1 NOMBRE DEL COMPUESTO
- 25. REGLAS PARA BAUTIZAR A UN COMPUESTO Con base en su número de oxidación
- 26. NÚMERO DE OXIDACIÓN Es un número entero con signo (+) o (-) que se le asigna a cada elemento y se escribe como exponente a la derecha del símbolo del elemento Este indica la cantidad de electrones ganados (negativo) o donados (positivo) por el átomo de un elemento al formar un compuesto METALES Número de oxidación positivo NO METALES Número de oxidación negativo
- 27. Estado puro • El número de oxidación es cero • H2, Cu, O2, Cl2, Fe Hidrógeno • Número de oxidación +1, excepto en los hidruros -1 • H2 O-2 Na+1H-1 Oxigeno • Número de oxidación de -2, excepto en los peróxidos -1 • Cu+2O-2, Na2O2 Suma algebraica • La suma algebraica de los números de oxidación de los elementos en un compuesto es igual a cero, ya que las moléculas son neutras • K+1 Mn+7O-2 +1 +7 -8 = 0 NÚMERODEOXIDACIÓN
- 28. ALCALINOS Y ALCALINOTÉRREOS GRUPO IA Li1+ Na1+ K1+ Rb1+ Cs1+ Fr1+ GRUPO IIA Be2+ Mg2+ Ca2+ Sr2+ Ba2+ Ra2+
- 29. CO2 C4+ + C2 O4O2- Los números subíndices te indican la proporción de átomos de cada uno de los elementos del compuesto C1 O2 Simplificación de las proporciones CO2 Representación final de la fórmula Formación de un compuesto Números de oxidación de cada elemento
- 30. HIDRUROS Estos se forman entre algunos metales con el elemento H (Hidrógeno). El metal tiene una electronegatividad menor al H. El número de oxidación del H es de -1 La suma de los números de oxidación entre el metal y el hidrógeno da “0” La forma de escribir su nombre es: Hidruro de ___________ (Nombre del metal).
- 31. Un ejemplo: CuH y CuH2 El cobre puede tener como número de oxidación 1+ o 2+, entonces… CuH = Hidruro de Cobre CuH2 = Hidruro de Cobre II
- 32. ÓXIDOS METÁLICOS Compuestos formados por un OXÍGENO y un METAL. La valencia del oxígeno es de 2. El número de oxidación del oxigeno es de 2- Un metal con valencia de 1 requiere: Dos átomos de metal por cada átomo de oxígeno Un metal con valencia de 2 requiere: Un átomo de metal y uno de oxígeno Un metal con valencia de 3 requiere: Dos átomos de metal por tres de oxígeno La forma de escribir su nombre es: Óxido de ___________ (Nombre del metal).
- 33. Un ejemplo: CoO y Co2O3 El cobre puede tener como número de oxidación 1+ o 2+, entonces… CoO = Óxido de Cobalto Co2 O3 = Óxido de Cobalto III
