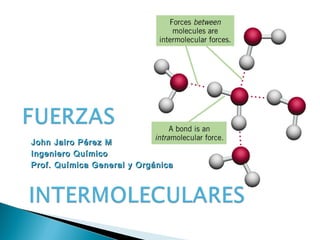
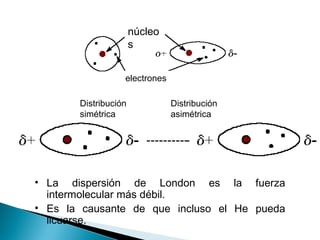
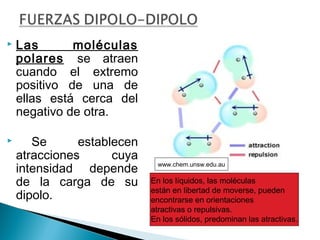
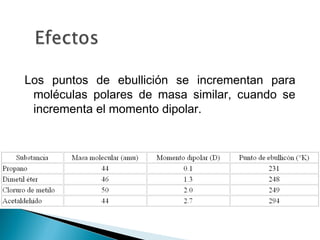
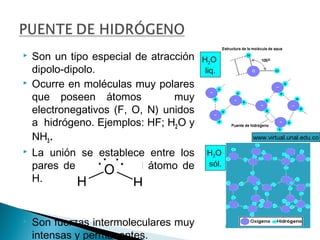
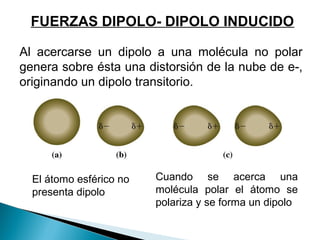
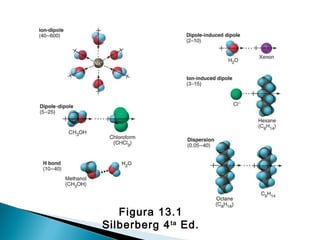
El documento describe las diferentes fuerzas intermoleculares que mantienen unidas las moléculas, incluyendo las fuerzas de van der Waals como la dispersión de London, las interacciones dipolo-dipolo y los puentes de hidrógeno. Explica cómo estas fuerzas débiles determinan propiedades físicas como los puntos de fusión y ebullición al afectar la organización molecular en los estados sólido y líquido.