MezclasSustanciasPuras
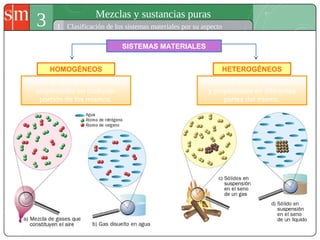
- 1. 3 Mezclas y sustancias puras 1 Clasificación de los sistemas materiales por su aspecto HOMOGÉNEOS HETEROGÉNEOS Tienen la misma composición y propiedades en cualquier porción de los mismos. Presentan distinta composición y propiedades en diferentes partes del mismo. SISTEMAS MATERIALES
- 2. MATERIA • Sustancias puras: Constituidas por un solo tipo de sustancias • Mezclas: Combinación de dos o más sustancias, en proporciones variables, pero conservando sus propiedades
- 3. SISTEMAS HETEROGÉNEAS • Existen sistemas materiales homogéneos formados por una sola sustancia o componente (agua-hielo) • Llamamos mezclas homogéneas a un sistema material homogéneo formado por dos o más sustancias
- 4. MEZCLAS HETEROGÉNEAS • Sus componentes son visibles a simple vista o con microscopio. • Los componentes pueden estar en cualquier estado (excepto que todos sean gases) • Un tipo especial: Suspensiones
- 5. MEZCLAS HETEROGÉNEAS Las mezclas heterogéneas presentan fases, en algunos casos los componentes se ven a simple vista, por ejemplo, la imagen de agua y aceite. En otros, es necesario usar instrumentos con mayor resolución para observar sus fases, como en las jaleas o la sangre.
- 6. OBSERVA LA FOTOGRAFÍA, ¿POR QUÉ ES UNA MEZCLA HETEROGÉNEA? Es una mezcla heterogénea porque sus componentes se pueden observar a simple vista.
- 7. Mezclas y sustancias puras 2 Separar los componentes de una mezcla heterogénea SEDIMENTACIÓN La gravedad separa los componentes de una mezcla con distinta densidad. Tras la sedimentación se decanta uno de los componentes. FILTRACIÓN Permite separar los componentes de una mezcla heterogénea de sólido y líquido haciéndolos atravesar un filtro. TAMIZADO Separación de dos sólidos de distinto tamaño de grano con un tamiz o criba que deje pasar sólo a los de menor tamaño
- 8. FILTRACIÓN Es uno de los procedimientos más empleados en los laboratorios. Se utiliza para separar los componentes de una mezcla heterogénea de sólido y líquido. Se basa en el tamaño de las partículas de la mezcla ya que al depositarlas sobre el papel de filtro, las más pequeñas pasan por los diminutos poros recogiéndose como filtrado, en tanto que los mayores, imposibilitadas de pasar, quedan sobre el papel de filtro constituyendo el residuo. Tomado del libro texto Requeijo Daniel y Alicia de Requeijo. Editorial Biósfera
- 9. TAMIZADO Procedimiento que permite separar partículas sólidas de distintos tamaños, haciendo pasar la mezcla por un tamiz. Un tamiz no es más que una malla que deja entre sus hilos una “luz” constante y conocida. La operación se efectúa manual o mecánicamente. En realidad nunca se consigue del todo una separación definitiva del material. Tomado del libro texto Fernández Casar y López Betancourt. Editorial Triangulo.
- 10. IMANTACIÓN Únicamente se aplica para separar un material magnético como el hierro cuando está mezclado con otro que no es magnético. Por ejemplo, para separar limaduras de hierro mezcladas con azufre o con arena. Basta con acercarle un imán y las limaduras de hierro serán atraídas por éste. Tomado del libro texto Requeijo Daniel y Alicia de Requeijo. Editorial Biósfera
- 11. DECANTACIÓN Tiene su fundamento en la diferencia de densidad que hay en los componentes de una mezcla. Si tenemos una mezcla de sólido y un líquido, se deja en reposo y observamos que el sólido más denso o pesado se va al fondo del recipiente y así es más fácil para separas el líquido el cual se inclina el recipiente que contiene ambas materias y se deja pasar el liquido a otro recipiente. En el caso de líquidos inmiscibles, se coloca un embudo de decantación, se deja reposar y se observa que el liquido más denso queda en la parte inferior del embudo, para su extracción se abre la llave del embudo hasta la salida total del liquido. Tomado del libro texto Fernández Casar y López Betancourt. Editorial Triangulo.
- 12. CENTRIFUGACIÓN Se utiliza cuando se quiere acelerar la sedimentación. Se coloca la mezcla dentro de una centrífuga (movimiento de rotación constante y rápido) lográndose que las partículas de mayor densidad se vayan al fondo y las más ligeras queden en la parte superior Tomado del libro texto Fernández Casar y López Betancourt. Editorial Triangulo.
- 13. LEVIGACIÓN Es el lavado de sólidos, con una corriente de agua. Los materiales más livianos son arrastrados una mayor distancia, de esta manera hay una separación de los componentes de acuerdo a lo pesado que sean. Esta técnica no es común en laboratorio pero es bastante frecuente en las industrias, ya sea para el lavado de arena o la obtención de oro. Tomado del libro de texto del María del Pilar Rodríguez. Editorial Salesiana
- 14. DISOLUCIÓN SELECTIVA Se pueden separar mezclas de dos sólidos donde uno de ellos se disuelve en un liquido y el otro no. Los procesos que tienen lugar son una disolución de un solido en un liquido y una filtración. Por ejemplo para separar una mezcla de arena y azúcar: El azúcar es soluble en agua, echamos la mezcla en agua de manera que el azúcar se disuelve, mientras que la arena no es miscible. La mezcla pasa a través del papel de filtro. El agua con el azúcar disuelto pasara y la arena quedara en el filtro. Dejando que se evaporen el agua del filtro y el agua del vaso con el azúcar, se consigue separar los dos sólidos.
- 15. Mezclas y sustancias puras 3 Separar los componentes de una mezcla homogénea CRISTALIZACIÓN Sirve para separar sólidos disueltos en un líquido. Se basa en las diferentes temperaturas de evaporación del sólido y del líquido. DESTILACIÓN Se utiliza para separar líquidos disueltos y se basa en la diferencia de temperaturas de ebullición de que cada componente. Cristales de sulfato de cobre obtenidos mediante cristalización Alambique o destilador
- 16. DESTILACIÓN Separación de líquidos disueltos en líquidos. Se basa en que cada sustancia hierve a una temperatura característica u por ello, al ser calentados hasta ebullición, en un aparato de destilación, cada sustancia se separa a una temperatura correspondiente a la de su punto de ebullición. Si por ejemplo se calienta agua salada, en el balón de destilación quedaría la sal y el agua pura se recoge en el destilado. Tomado del libro texto Requeijo Daniel y Alicia de Requeijo. Editorial Biósfera
- 17. DESTILACIÓN Separación de mezclas de gases (aire). Primera etapa: Se comprime el aire a altas presiones y se deja expandir rápidamente, el aire se licua. Segunda etapa: Se eleva la temperatura de forma gradual (destilación fraccionada). Permite obtener cada fracción por separado
- 18. EVAPORACIÓN Se utiliza para separar sólidos disueltos en líquidos. Calentando, uno escapa en forma de gas y el otro queda como residuo en el recipiente donde se calentó. Al calentar agua salada, el agua se evapora y queda la sal como residuo. El tamaño de los cristales depende de la velocidad de evaporación (a más rapidez, más pequeños son los cristales)
- 19. CRISTALIZACIÓN Se utiliza para la purificación de sustancias sólidas. Se fundamenta en el hecho que la inmensa mayoría de las sustancia sólidas son más solubles en un disolvente caliente que en uno frío. El solido que se va a purificar se disuelve en el disolvente caliente, se filtra para eliminar impurezas y luego la mezcla se enfría para que se produzca la cristalización Tomado del libro texto Freddy Suárez. Editorial Romor
- 20. DISOLUCIÓN SELECTIVA Se pueden separar mezclas de varios gases donde uno de ellos se disuelve en un liquido y los otros no. Para ello se burbujea la mezcla por el líquido, disolviéndose el componente deseado. Más tarde se calienta la disolución para separar el gas.
- 21. CROMATOGRAFÍA Este procedimiento consiste en la separación de componentes de una mezcla líquida basándose en las diferencias de velocidades con las que éstos se movilizan (capilaridad) por la superficie porosa del papel de cromatografía o de filtro, cuando previamente se ha usado una mezcla de disolvente.
- 22. 3 Mezclas y sustancias puras 4 Ciencias de la Naturaleza 3º ESODisoluciones Una disolución es una mezcla homogénea y estable de dos o más sustancias. DISOLVENTE SOLUTO EJEMPLO Sólido Líquido Gas Gas Líquido Sólido Hidrógeno en platino Amalgamas Aleaciones Gas Líquido Sólido Agua con “gas” Alcohol en agua Azúcar en agua Gas Líquido Sólido Aire Niebla Humo TIPOS DE DISOLUCIONESTIPOS DE DISOLUCIONES
- 23. Mezclas y sustancias puras 5 Concentración de una disolución La concentración de una disolución se define como la proporción de soluto en la disolución. óne disolucicantidad d e solutocantidad d iónConcentrac = FORMAS DE EXPRESAR LA CONCENTRACIÓN GRAMOS POR LITRO TANTO POR CIENTO EN VOLUMEN TANTO POR CIENTO EN MASA 100 disolucióndemasa solutodemasa masaen% = 100 disolucióndevolumen solutodevolumen en volumen% = litrosendisolucióndevolumen solutodegramos iónConcentrac =
- 24. 3 Mezclas y sustancias puras 6 Preparar una disolución de una concentración dada Preparar 250 cm3 de hidróxido de sodio de concentración 16 g/L disoluciónL solutog C = 11 Calcular la masa de hidróxido de sodio. disoluciónLCsolutog ⋅= g40,2516 =⋅= 22 Pesar 4 g de hidróxido de sodio. 33 Disolver con un poco de agua destilada. 44 Verter en un matraz aforado de 250 cm3 . 55 Enrasar con una bureta hasta el aforo (en este caso 250 mL).
- 25. Mezclas y sustancias puras 7 Solubilidad Solubilidad es la máxima cantidad de soluto que se puede disolver en una cantidad de disolvente a una temperatura determinada. DISOLUCIÓN SATURADA Aquella que no admite más soluto, a no ser que se añada más disolvente o se modifique la temperatura. DILUIDA El soluto se disuelve poco en el disolvente. CONCENTRADA El soluto es muy soluble en el disolvente. Puede ser Gramos de soluto por cada 100 g de disolvente a una temperatura dada. EXPRESIÓN DE LA SOLUBILIDAD Ej. La solubilidad de la sal en agua a 60o es de 32,4
- 26. CONCENTRACIÓN DE UNA DISOLUCIÓN Es interesante conocer que con la densidad se pueden relacionar el tanto por ciento en masa con la concentración en gramos/Litro g/L % en masa densidad
- 27. Mezclas y sustancias puras 9 Reconocimiento de sustancias puras La temperatura de ebullición es una propiedad característica de las sustancias puras. La temperatura se mantiene constante durante el proceso de ebullición La temperatura aumenta gradualmente durante la ebullición SUSTANCIA PURA MEZCLA HOMOGÉNEA
- 28. 3 Mezclas y sustancias puras 10 Ciencias de la Naturaleza 3º ESOClasificación de la materia MATERIA Según el número de componentes se clasifica en HOMOGÉNEA HETEROGÉNEA HOMOGÉNEA HETEROGÉNEA Puede ser Puede ser SUSTANCIA PURA (Un componente) MEZCLA (más de un componente)
- 29. Mezclas y sustancias puras 11 Separación de los componentes de un compuesto DESCOMPOSICIÓN TÉRMICA DESCOMPOSICIÓN POR ELECTRÓLISIS Descomposición mediante calor. Una sustancia se descompone por la acción de una corriente eléctrica continua.
- 30. Mezclas y sustancias puras Un compuesto no es una mezcla Los constituyentes de una mezcla pueden encontrarse en cualquier proporción. Los constituyentes de un compuesto están siempre en la misma proporción. OXÍGENO HIDRÓGENO Agua Mezcla Compuesto +
