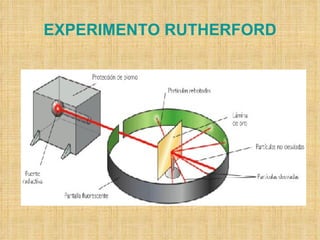
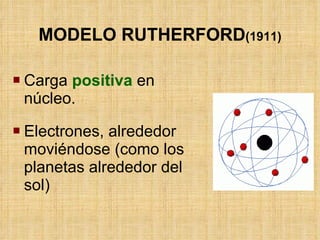
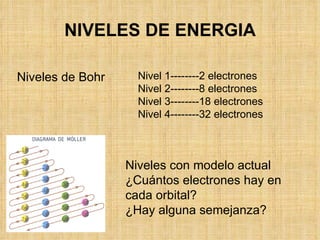
El documento describe la evolución de los modelos atómicos a través del tiempo. Comenzando con el modelo de Dalton de átomos esféricos e indivisibles, luego el modelo de Thomson con un átomo formado por electrones distribuidos en una matriz positiva, y finalmente el modelo de Rutherford con un núcleo positivo y electrones en órbitas alrededor de él. Posteriormente, el modelo de Bohr corrigió las limitaciones de Rutherford al proponer que los electrones solo pueden tener ciertos niveles de energía cuantizados.