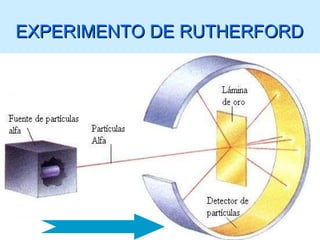
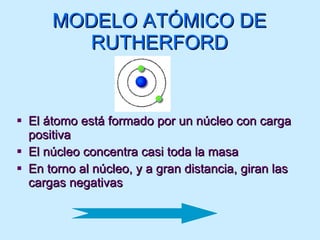
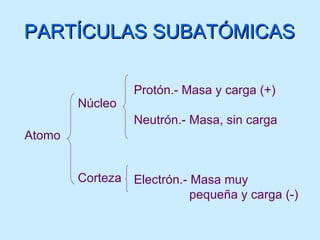
El documento describe la evolución del modelo atómico desde las teorías de Leucipo y Demócrito hasta el modelo de Bohr. Se introdujo la idea de que la materia está compuesta de átomos indivisibles. Más tarde, experimentos como el de Rutherford mostraron que el átomo consiste en un núcleo positivo rodeado de electrones. El modelo de Bohr propuso que los electrones orbitan el núcleo en órbitas estables cuantizadas.