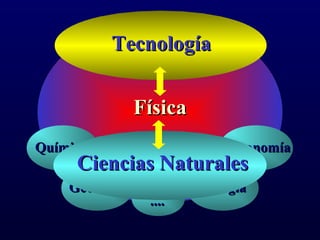
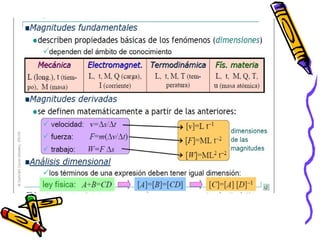
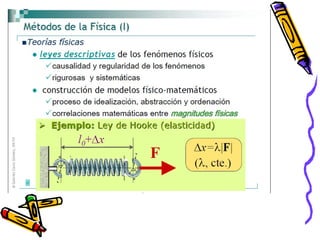
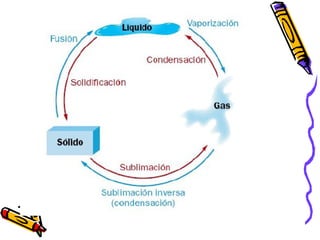
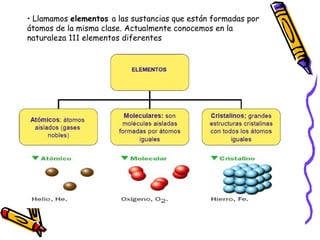
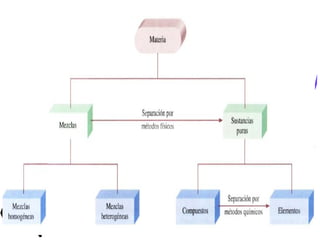
Este documento proporciona una introducción a la físico-química y la química. Explica que la físico-química estudia los principios físicos que gobiernan los sistemas químicos desde perspectivas micro y macroscópicas. También describe los objetivos de la físico-química, las propiedades de los diferentes estados de la materia, y conceptos clave como átomos, moléculas, elementos, compuestos, sustancias puras y mezclas. Además, introduce conceptos de



























![Medida de la masa
• Masa Atómica
Es la masa del átomo de cualquier elemento comparada con la uma (doceava
parte del isotopo del carbono 12) y equivale a 1,66 . 10 -24g. por tanto, la masa
atómica es un numero relativo.
• Ejem. La masa atómica del calcio es de 40 uma [M (Ca) = 40]
• Masa Atómica gramo o átomo gramo
Es el numero de gramos igual al de la masa atómica. Se representa por at-g.
• Ejem. La masa atómica gramo del sodio es 23 g/át-g
• Masa molecular
Es la masa de uma que resulta de sumar las masas de los átomos que forman la molécula. Se representa por M (m). Es un número relativo, ya que se obtiene por
comparación con la doceava parte del isótopo del carbono doce.
Ejem. El acido sulfurico (H
SO
4
2
) tiene de masa molecular 98 uma.
Masa molecular gramo
Es el numero de gramos igual a la masa molecular de la sustancia.](https://image.slidesharecdn.com/1-141203060651-conversion-gate01/85/1-introduccon-fisicoquimica-34-320.jpg)


