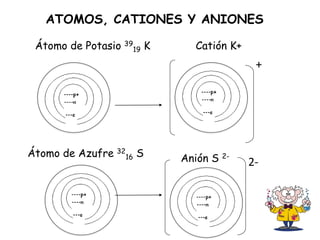
Este documento describe las propiedades físicas de los metales y no metales, así como los diferentes tipos de enlaces iónicos y covalentes que pueden formarse entre átomos. También explica cómo se forman diversos compuestos inorgánicos como óxidos, anhídridos, hidróxidos y ácidos a partir de la combinación de metales y no metales, y cómo las sales se producen a través de la reacción de un hidróxido con un ácido.