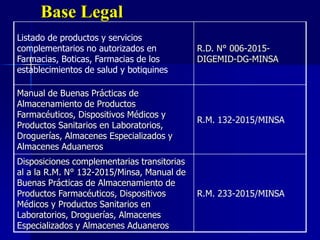
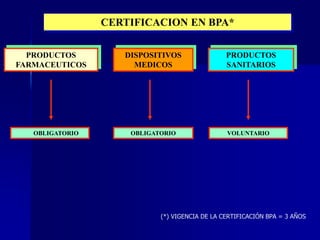
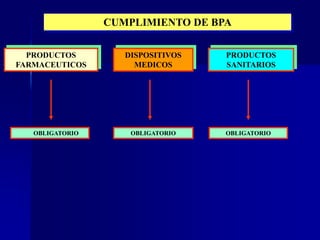
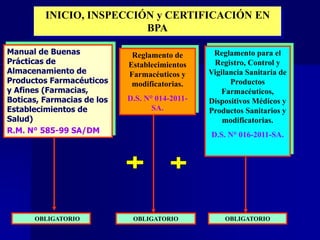
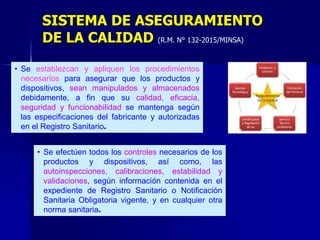
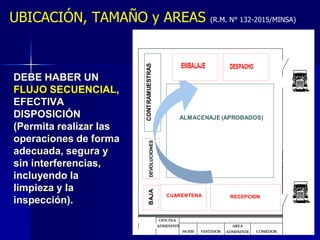
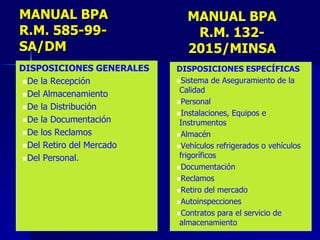
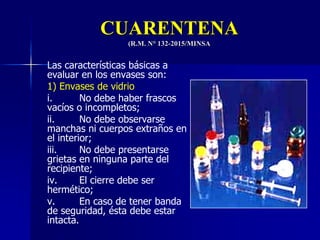
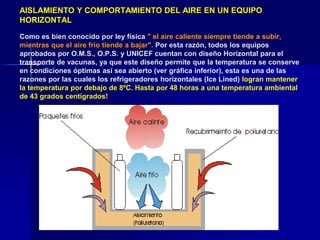
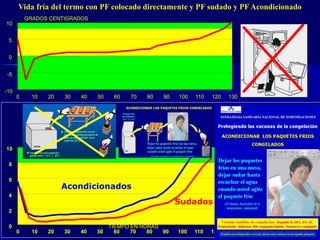
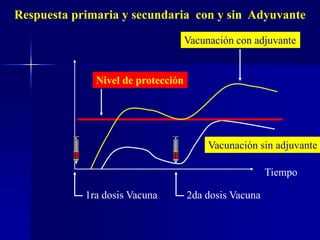
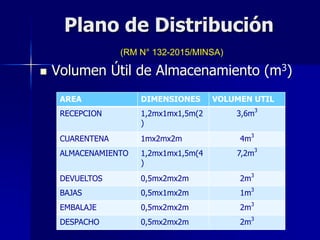
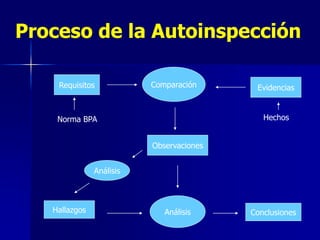
Este documento presenta las buenas prácticas de almacenamiento (BPA) en Perú. Explica que las BPA establecen normas y procedimientos para garantizar que los productos farmacéuticos, dispositivos médicos y productos sanitarios se mantengan en óptimas condiciones durante el almacenamiento. También describe los diferentes tipos de establecimientos sujetos a las BPA y la normativa legal que las rige.