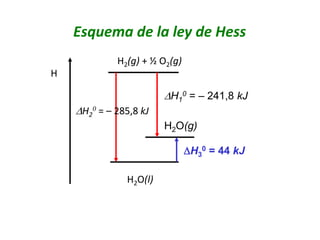
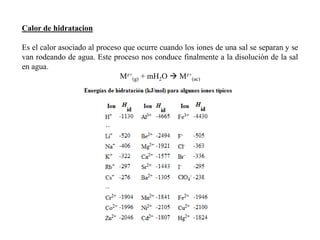
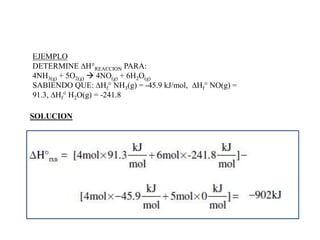
Este documento presenta conceptos clave de termoquímica. Explica que la energía de una reacción química se relaciona con las masas y moles de sustancias involucradas. Define procesos endotermicos y exotermicos. También describe ecuaciones termoquímicas, entalpía de reacción, entalpía de formación, combustión y vaporización, así como la ley de Hess para calcular cambios de entalpía.






![Los valores de DHf nos permiten encontrar los valores de las entalpías
de reacción (DHreaccion).
DHreaccion=[ ∑n DHf (25oc)]productos-[∑n DHf (25oc)]reactivos
n: representa los coeficientes estequiométricos de cada reactivo o producto de
la reacción en cuestión](https://image.slidesharecdn.com/3-220404234154/85/3-3-Termoquimica-2022-pptx-9-320.jpg)

![Entalpia de enlace o energia de enlace
En toda reacción química los enlaces de los reactantes deben romperse para rearreglarse y
dar paso a la formación de nuevos enlaces.
Puesto que la entalpía de enlace depende de la molécula, se tabulan valores promedio.
¡Ojo! * Método aproximado ESTIMACION
Fiabilidad: ± 10 kJ como máximo
* Sólo es aplicable a reacciones entre
gases.
∆Ho=[ ∑n EEenlace]Reactivos-[ ∑n EEenlace]Productos
∆Ho=[ ∑n EEenlace]rotos-[ ∑n EEenlace]formados
Enlace Ee (kJ/mol)
H–H 436
C–C 347
C=C 620
CC 812
O=O 499
Cl–C 243
C–H 413
C–O 315
C=O 745
O–H 460
Cl–H 432](https://image.slidesharecdn.com/3-220404234154/85/3-3-Termoquimica-2022-pptx-12-320.jpg)