Las tres oraciones resumen lo siguiente:
1) El documento trata sobre reacciones químicas y sus características.
2) Las reacciones químicas involucran la transformación de sustancias reactivas en productos y pueden evidenciarse a través de cambios de color, formación de precipitados o gases, o desprendimiento de energía.
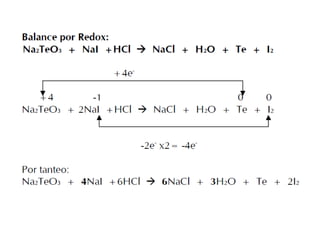
3) Se describen diferentes tipos de reacciones como de precipitación, ácido-base, y redox, así como los pasos para balancear reacciones redox.