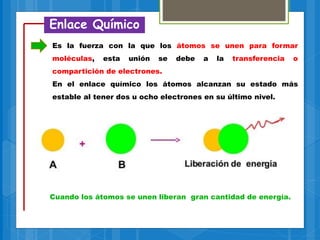
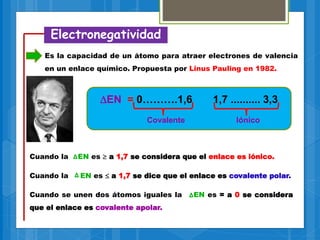
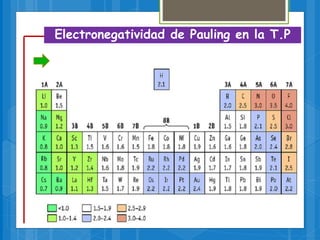
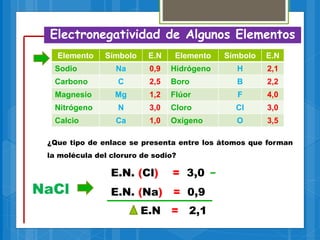
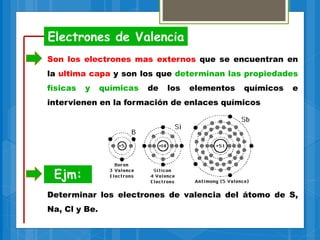
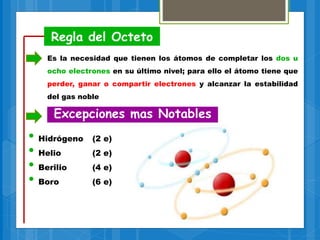
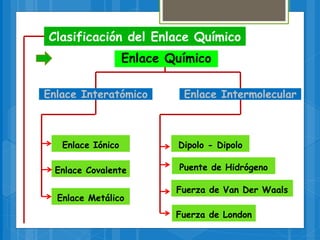
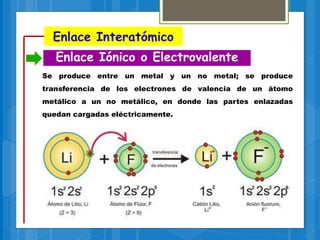
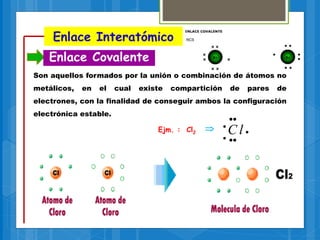
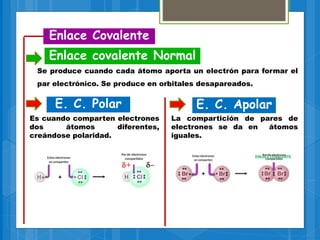
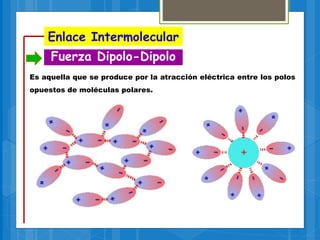
El documento describe los diferentes tipos de enlaces químicos, incluyendo enlaces iónicos, covalentes, metálicos e intermoleculares. Explica que los enlaces se forman por la transferencia o compartición de electrones entre átomos y dependen de factores como la electronegatividad de los átomos involucrados. También define conceptos clave como electrones de valencia, regla del octeto y notación de Lewis.