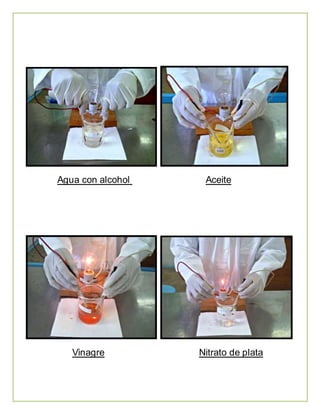
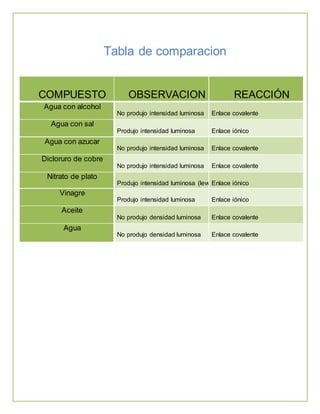
Este documento describe una práctica de laboratorio sobre los diferentes tipos de enlaces químicos. Explica los enlaces iónico, covalente y metálico, e incluye una tabla con los resultados de experimentos que identificaron estos enlaces mediante la conductividad eléctrica de varias sustancias en solución. Los estudiantes concluyeron que las sustancias con el mismo tipo de enlace son solubles entre sí, mientras que sustancias con enlaces diferentes no lo son.