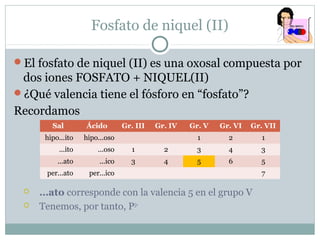
Este documento explica la importancia de la densidad en el cálculo de la concentración de disoluciones. La densidad relaciona la masa y el volumen, lo que permite pasar entre unidades de concentración como g/L, molaridad y porcentaje en masa. Se proveen dos ejemplos numéricos mostrando cómo usar la densidad conocida de una disolución de H2SO4 para calcular su concentración en estas diferentes unidades.