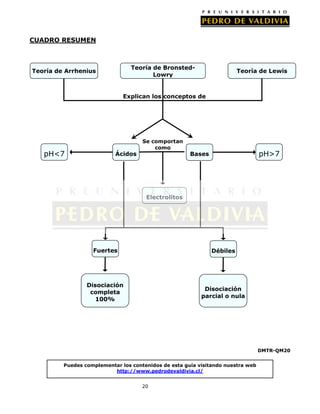
1. El documento describe varias teorías sobre las reacciones ácido-base, incluyendo las teorías de Arrhenius, Brønsted-Lowry y Lewis.
2. Según la teoría de Arrhenius, los ácidos liberan iones H+ y las bases liberan iones OH- en agua. Según Brønsted-Lowry y Lewis, las reacciones ácido-base implican la transferencia o intercambio de protones H+ o electrones.
3. Las sustancias se consideran ácidos o bases fuertes dependiendo de su











![EL GRADO DE ACIDEZ DE UNA SUSTANCIA
CONCEPTO DE pH
El grado de acidez de una sustancia (su concentración dde protones) puede medirse considerando
una escala absoluta que se deriva a partir del análisis ácido base del agua. Esta sustancia neutra,
presenta una reacción de disociación que genera los iones que precisamente se estudian en el
comportamiento ácido – base de cualquier sustancia (H+ y OH-). El valor de la fuerza que permite
la disociación es bastante bajo (casi incalculable), de modo que para hacerlo tangible se opera con
una función matemática (logaritmo) que amplifica el valor 1·10 -14.
De acuerdo con la reacción de disociación para el agua:
H2O
H+
+
OH-
KW = 1∙10-14 = [H+]·[OH-]
Donde Kw es la constante de equilibrio del agua (constante de fuerza), H+ representa al ácido
mientras que OH- es la base obtenida. Si los valores para H+ y OH- son iguales se puede afirmar
que el sistema está totalmente neutralizado y que el producto tiene un valor igual a 1·10-14
(condición central en la gráfica).
Premisas importantes en el comportamiento ácido base de una sustancia:
1
•Una gran concentración de H+ determina que una solución sea
ÁCIDA.
2
•Una gran concentración de OH- determina que una solución sea
BÁSICA
3
•Si la concentración de H+ y la de OH- son iguales, entonces la
solución es NEUTRA
12](https://image.slidesharecdn.com/qm20290713-131115232310-phpapp01/85/Reacciones-Acido-Base-QM20-PDV-2013-12-320.jpg)
![Siguiendo con el análisis de la ecuación de disociación para el agua podemos decir que la
expresión para la situación de equilibrio químico viene dada por:
KW =
H+
∙
OH-
= 10-14
Por lo tanto, ya sea que se trate de una solución ácida, básica o neutra, SIEMPRE se
debe cumplir que:
H+
∙
OH-
= 10-14
Con la expresión anterior podremos hacer algunos calculos para determinar el grado de acidez de
algunas soluciones:
Ejemplo 1
Si
10-1 4
Kw
H+ = 10-3 M, eso implica que OH- = + =
10-3
[H ]
Por lo tanto:
OH- = 10-11 M
Comparando
H+ = 10-3 M con
ácida, ya que, H+
OH-
OH-
= 10-11M se puede concluir que se trata de una solución
Ejemplo 2
Si
H+ = 10-9 M, implica que
Como
H+
OH- = 10-5
OH- , se trata de una solución básica.
LA ESCALA DE pH
El operador p
En matemáticas un operador es un símbolo que indica que se debe llevar a cabo una operación sobre
un cierto número de operandos, por ejemplo:
el
el
el
el
signo + equivale a sumar
signo – equivale a restar
signo x equivale a multiplicar
signo p es aplicar –logaritmo
El operador p es usado para hacer que números muy pequeños se transformen en otros más
manejables, por ejemplo,
0,00001 al aplicarle – log(0,00001) queda como 5, un número más fácil de expresar. Cuando se
mide la acidez de una solución se mide, en otras palabras, la concentración de iones H+, estos
suelen tener concentración muy baja por eso se les aplica el operador p para hacer que esa
concentración sea más manejable, así nace el concepto de pH.
El pH se suele definir como el “logaritmo negativo de la concentración de ión hidrógeno”.
pH = -log
13
H+](https://image.slidesharecdn.com/qm20290713-131115232310-phpapp01/85/Reacciones-Acido-Base-QM20-PDV-2013-13-320.jpg)



![Ejemplo
¿Qué volumen de solución acuosa de Mg(OH)2 4 M habrá que agregar a 500 mL de una solución
de HNO3 2M para neutralizarla completamente?
La ecuación para neutralización es parecida a quella usada anteriormente en dilución, sólo que
ahora se igualan las cantidades de H+ y de OH-.
[H+]
=
[OH-]
Các · Vác · N°H+ = Cba · Vba · N°OHDesarrollo:
2 M · 500 mL · 1 = 4 M · X · 2
x = 2M · 500 mL
4M · 2
x = 125 mL
INDICADORES DE pH
En la actualidad el pH de una solución se mide de forma electrónica, a pesar de esto en la mayoría
de los laboratorios se sigue usando un trozo de papel impregnado con sustancias coloreadas que
cambian su color de acuerdo al pH en el que se encuentran. Estas sustancias coloreadas reciben el
nombre de indicadores de pH. En la tabla siguiente se muestran algunos de los indicadores más
usados con sus respectivos cambios de color.
17](https://image.slidesharecdn.com/qm20290713-131115232310-phpapp01/85/Reacciones-Acido-Base-QM20-PDV-2013-17-320.jpg)