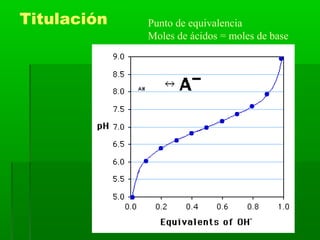
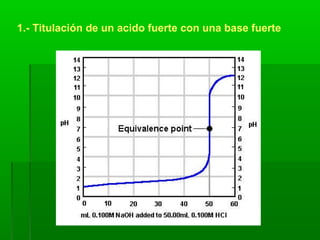
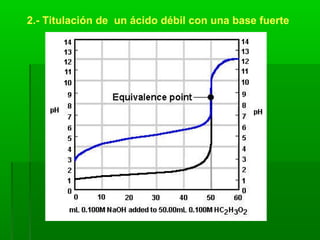
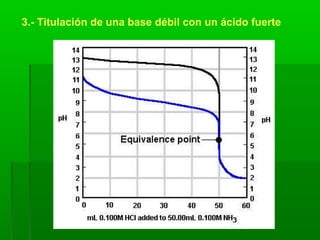
El documento trata sobre los sistemas ácido-base. Explica el sistema conjugado de ácidos y bases, la ionización del agua y el pH. También describe las disoluciones amortiguadoras y la hidrólisis de sales, así como los tipos de titulaciones ácido-base.




![. Ionización del
agua y concepto de pH.
H2O + H2O H3O+
+ OH-
Kw = [H3O+
][OH-
]](https://image.slidesharecdn.com/acidobase32015-150930165233-lva1-app6892/85/Acido-base-3-2015-10-320.jpg)
![A 25 ºC se cumple que:
Kw = [H3O+
] . [OH-
] = 10-14
Sacando logaritmos y cambiando el signo
-Log Kw = - Log [H3O+
] - Log [OH-
]
pKw = pH + pOH = 14
Esta expresión permite relacionar las
concentraciones de iones hidronio e hidroxilo en
una disolución](https://image.slidesharecdn.com/acidobase32015-150930165233-lva1-app6892/85/Acido-base-3-2015-11-320.jpg)
![[ H3
O+
] pH carácter
10 -1
1 ácido
10 -2
2 ácido
10 -3
3 ácido
10 -4
4 ácido
10 -5
5 ácido
10 -6
6 ácido
10 -7
7 neutro
10 -8
8 básico
10 -9
9 básico
10 -10
10 básico
10 -11
11 básico
10 -12
12 básico
10 -13
13 básico
10 -14
14 básico](https://image.slidesharecdn.com/acidobase32015-150930165233-lva1-app6892/85/Acido-base-3-2015-12-320.jpg)

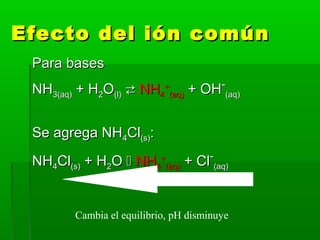
![Efecto del ión comúnEfecto del ión común
Ejemplo:Ejemplo:
2.0 M HF2.0 M HF(aq)(aq) tiene un pH = 1.4tiene un pH = 1.4
Se agrega NaFSe agrega NaF(s)(s) hasta [NaFhasta [NaF(aq)(aq)] = 2.0 M,] = 2.0 M,
calcular el pHcalcular el pH
(K(Kaa (HF) = 7.2 x 10(HF) = 7.2 x 10-4-4
))](https://image.slidesharecdn.com/acidobase32015-150930165233-lva1-app6892/85/Acido-base-3-2015-15-320.jpg)

![Efecto del ión comúnEfecto del ión común
Ka = 7.2 x 10-4
= [H3O+
] [F
-
]
[HF]
x (2.0 + x)
2.0 - x
=
≈
X (2.0)
2.0
(x se desprecia)
≈ x](https://image.slidesharecdn.com/acidobase32015-150930165233-lva1-app6892/85/Acido-base-3-2015-17-320.jpg)
![Efecto del iónEfecto del ión
comúncomún
[H[H33OO++
] = x = 7.2 x 10] = x = 7.2 x 10-4-4
MM
pH = -logpH = -log1010 (7.2 x 10(7.2 x 10-4-4
))
= 3.14= 3.14
(era 1.4 antes de la adición de NaF)(era 1.4 antes de la adición de NaF)](https://image.slidesharecdn.com/acidobase32015-150930165233-lva1-app6892/85/Acido-base-3-2015-18-320.jpg)

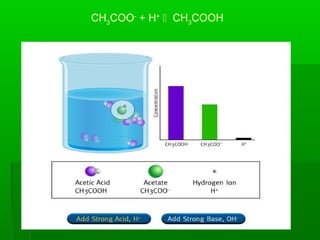


![Ka =
[ A-
] [H3
O+
]
[ AH ]
=
[ A-
]
[H3
O+
]
[ AH ]
Ka
=
[ A-
]
-Log [H3
O+
]
[ AH ]
-Log Ka- Log
AH A-
+ H3
O+
=
[ A-
]
pH
[ AH ]
pKa + Log
Ecuación de Henderson-Hasselbalch](https://image.slidesharecdn.com/acidobase32015-150930165233-lva1-app6892/85/Acido-base-3-2015-24-320.jpg)


![2.- Sal de ácido fuerte y base débil
HCl + NH3
NH4
Cl
Ejemplos: NH4Cl, NH4NO3,
etc.
Cl-
no hidroliza
NH4
+
hidroliza
NH4
Cl + H2
O NH4
+
+ Cl-
NH4
+
+ H2
O NH3+ H3
O+
La sal producida genera una disolución ácida
Ka =
[NH3] [H3
O]
[NH4
+
]](https://image.slidesharecdn.com/acidobase32015-150930165233-lva1-app6892/85/Acido-base-3-2015-27-320.jpg)
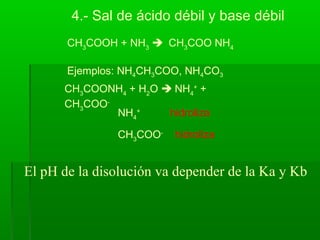
![CH3
COOH + NaOH CH3
COONa
Ejemplos: CH3COONa, KCN, Na2CO3, etc.
Na+
no hidroliza
CH3
COO-
hidroliza
3.- Sal de ácido débil y base fuerte
CH3
COO Na + H2
O Na+
+ CH3
COO-
CH3
COO-
+ H2
O CH3
COOH + OH-
Kb =
[ CH3
COOH ][ OH-
]
[ CH3
COO-
]
La sal producida genera una disolución básica](https://image.slidesharecdn.com/acidobase32015-150930165233-lva1-app6892/85/Acido-base-3-2015-28-320.jpg)