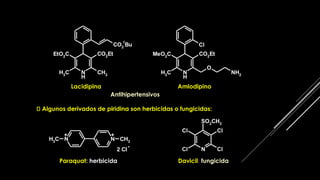
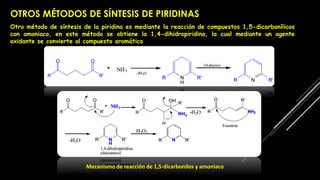
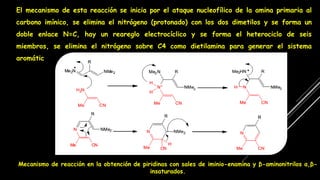
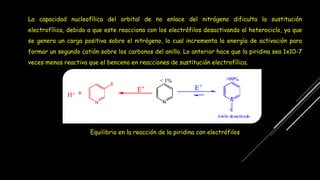
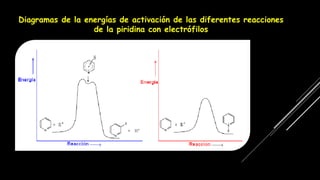
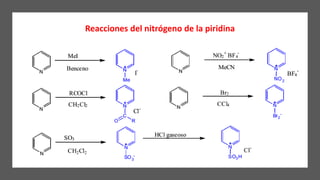
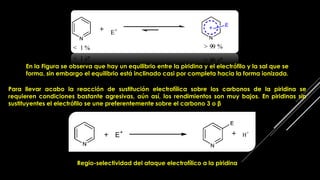
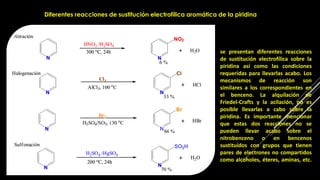
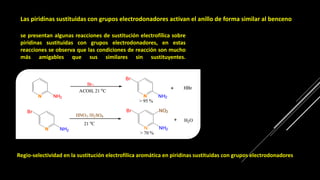
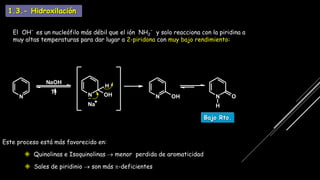
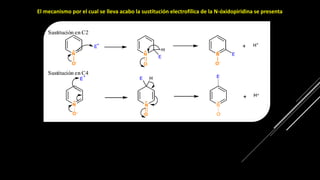
La piridina y sus derivados son compuestos aromáticos utilizados como bases y disolventes. La piridina se aisló por primera vez de huesos pirolizados y su nombre deriva del griego "pyr" fuego y "idina". Existen varios métodos de síntesis de la piridina, como la reacción de Hantzsch o la reacción de compuestos 1,5-dicarbonílicos con amoníaco. Muchos derivados de la piridina tienen aplicaciones terapéuticas o como herbicidas.