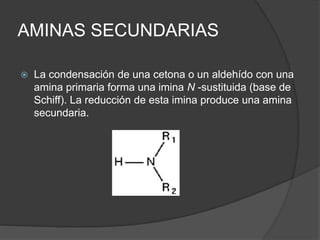
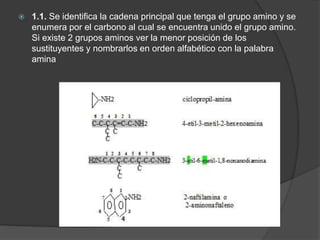
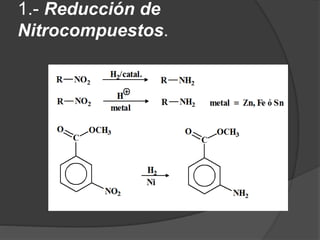
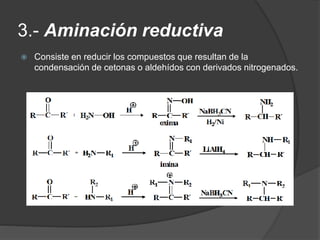
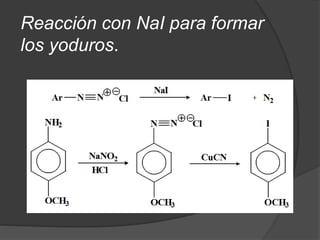
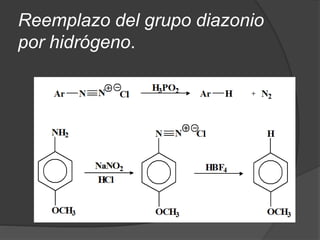
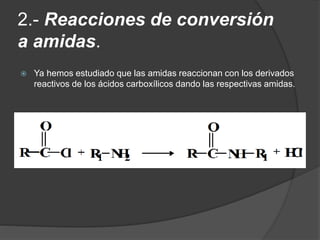
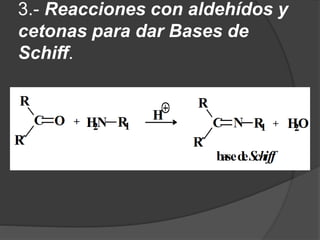
El documento describe las propiedades y clasificación de las aminas. Las aminas son compuestos orgánicos derivados del amoníaco donde se sustituyen uno, dos o tres hidrógenos por grupos alquilo. Según la cantidad de sustituciones, las aminas son primarias, secundarias o terciarias. También se detallan algunos usos industriales importantes de las aminas como desinfectantes, inhibidores de corrosión y agentes de flotación.






























![- suavizantes de tejidos y
cabellos
Las moléculas se fijan sobre las fibras por su parte iónica formando
una capa hidrófoba que impide su adherencia al secarse y
proporciona suavidad. Los compuestos utilizados con este fin
incluyen dos cadenas hidrocarbonadas largas en la molécula.
[(CH3-(CH2)n-CH2-CH2)2-N(CH3)2] Br](https://image.slidesharecdn.com/aminas-161102220738/85/Aminas-39-320.jpg)




