Apuntes de quimica copia
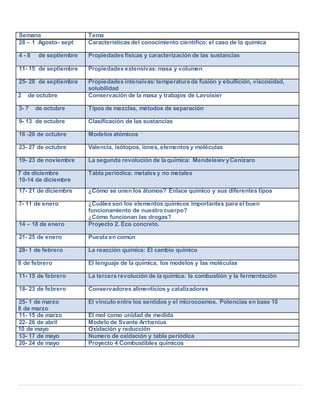
- 1. Semana Tema 28 – 1 Agosto- sept Características del conocimiento científico: el caso de la química 4 - 8 de septiembre Propiedades físicas y caracterización de las sustancias 11- 15 de septiembre Propiedades extensivas:masa y volumen 25- 28 de septiembre Propiedades intensivas:temperatura de fusión y ebullición, viscosidad, solubilidad 1- 2 de octubre Conservación de la masa y trabajos de Lavoisier 3- 7 de octubre Tipos de mezclas, métodos de separación 9- 13 de octubre Clasificación de las sustancias 16 -20 de octubre Modelos atómicos 23- 27 de octubre Valencia, isótopos, iones, elementos y moléculas 19- 23 de noviembre La segunda revolución de la química: Mendeleiev yCenízaro 2- 7 de diciembre 10-14 de diciembre Tabla periódica: metales y no metales 17- 21 de diciembre ¿Cómo se unen los átomos? Enlace químico y sus diferentes tipos 7- 11 de enero ¿Cuáles son los elementos químicos importantes para el buen funcionamiento de nuestro cuerpo? ¿Cómo funcionan las drogas? 14 – 18 de enero Proyecto 2. Eco concreto. 21- 25 de enero Puesta en común 28- 1 de febrero La reacción química: El cambio químico 4- 8 de febrero El lenguaje de la química, los modelos y las moléculas 11- 15 de febrero La tercera revolución de la química: la combustión y la fermentación 18- 23 de febrero Conservadores alimenticios y catalizadores 25- 1 de marzo 5- 8 de marzo El vinculo entre los sentidos y el microcosmos. Potencias en base 10 11- 15 de marzo El mol como unidad de medida 22- 26 de abril Modelo de Svante Arrhenius 6- 10 de mayo Oxidación y reducción 13- 17 de mayo Numero de oxidación y tabla periódica 20- 24 de mayo Proyecto 4 Combustibles químicos
- 2. La Química, la tecnología y tú QUIMICA ES LA CIENCIA QUE ESTUDIA LOS FENOMENOS INTERNOS DE LA MATERIA Y LA ENERGIA CIENCIA ES UN CONOCIMIENTO FENOMENOS ES UN CAMBIO O TRANSFORMACION CAMBIO ES LA MODIFICACION DE UN SUSTANCIA QUE NO ALTERA SUS CARACTERISTICAS TRANSFORMACION ES LA MODIFICACION DE UNA SUSTANCIA CAMBIANDO SUS CARATERISTICAS MATERIA ES TODO LO QUE OCUPA UN LUGAR EN EL ESPACIO Y TIENE PESO ENERGIA ES LA CAPACIDAD DE PRODUCIR UN TRABAJO O MOVIMIENTO ESPACIO ES UN LUGAR VACIO PESO ES EL RESULTADO DE LA FUERZA DE GRAVEDAD TRABAJO ES LA OBTENCION DE UN BENEFICIO A TRAVES DE UN ESFUERZO
- 3. RELACION DE LA QUIMICA CON OTRAS CIENCIAS ¿CUAL ES SU CAMPO DE ESTUDIO? Todo es química y su transformación está en todo nuestro alrededor, desde el agua, hasta los ácidos nucleicos
- 4. ¿ Cómo ha beneficiado la química a la humanidad? Con los diferentes estudios y experimentos que se han realizado han descubierto lo que se puede hacer con los diferentes elementos de la naturaleza, haciendo, con estas invenciones, la vida del ser humano mas cómoda, fácil, entretenida, etc. como con el uso de automóviles, computadoras, detergentes, cosméticos, etc.
- 6. Si la química ha ayudado a mejorar nuestras vidas, ¿porqué no es aceptada
- 7. LA DIVERSIDAD DE LAS PROPIEDADES DE LOS MATERIALES Y SU CLASIFICACION QUIMICA SUS CUALIDADES Todo lo que nos rodea, incluyendo a los seres vivos, es materia. La materia es todo lo que ocupa un lugar en el espacio. Se puede medir y pesar, y encontrar en diversos estados: solido, liquido y gaseoso. La materia presenta diversas propiedades que la caracterizan, algunas de ellas identifican a toda la materia, por ello se les llama propiedades generales; otras, como las propiedades particulares de la materia solida, precisan ciertas caracteristicas de un grupo; y las que determinan las diferencias entre una sustancia y otra se llaman propiedades especificas.
- 8. Las propiedades generales de la materia son:
- 9. Entre las propiedades particulares de los solidos estan:
- 10. Propiedades intensivas o específicas Son aquellas que no varían con la cantidad de materia considerada Cuando la propiedad intensiva se multiplica por la cantidad de sustancia (masa) se tiene una propiedad que sí depende de la cantidad de sustancia presente y se llama propiedad extensiva, como ocurre con la masa, con la cantidad de movimiento y con el momento de la cantidad de movimiento.
- 11. Propiedades químicas de la materia también conocidos como Fenómenos o Transformaciones Químicas Son procesos en los que cambia la naturaleza de las sustancias, además de formarse otras nuevas. Ejemplos: OXIDACION: es la degradación de los materiales por presencia del oxigeno SE DA EN METALES Y SERES VIVOS PUTREFACCION: degradación de una sustancia por proceso físico o químico COMBUSTION: la acción de los cuerpos de arder por presencia de oxigeno
- 12. REACTIVIDAD: capacidad para reaccionar en presencia de otras sustancias RESPIRACION: INTERCAMBIOS DE GASES (OXIGENO A BIOXIDO DE CARBONO) DIGESTION: TRANSFORMACION DE LOSALIMENTOS A ENERGIA SUSTANCIAS QUIMICAS QUE INTERVIENEN ENELAMOR APEGO: OXITOCINA Y VASOPRESINA ATRACCION: DOPAMINA, NOREPINEFRINA, SEROTONINA DESEO SEXUAL : TESTOSTERONA, ESTROGENO
- 13. ESTADOS DE AGREGACIÓN DE LA MATERIA (1 de marzo de 2018) ESTADO SOLIDO: Las sustancias en estado sólido suelen presentar algunas de las siguientes características: Cohesión elevada. Forma definida. Incompresibilidad. Resistencia a la fragmentación. Fluidez muy baja o nula. Algunos de ellos se subliman. ESTADO LIQUIDO: Si se incrementa la temperatura, el sólido va perdiendo forma hasta desaparecer la estructura cristalina, alcanzando el estado líquido. El estado líquido presenta las siguientes características: Cohesión menor. Movimiento energía cinética. No poseen forma definida. Toma la forma de la superficie o el recipiente que lo contiene. En el frío se contrae (exceptuando el agua). Posee fluidez a través de pequeños orificios. Puede presentar difusión. Volumen constante
- 14. ESTADO GASEOSO Incrementando aún más la temperatura, se alcanza el estado gaseoso. Las moléculas del gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. El estado gaseoso presenta las siguientes características: Cohesión casi nula. No tienen forma definida. Su volumen es variable. ESTADO PLASMÁTICO: De esta forma el plasma es un estado parecido al gas pero compuesto por aniones y cationes (iones con carga negativa y positiva, respectivamente), separados entre sí y libres, por eso es un excelente conductor. Un ejemplo muy claro es el Sol. La materia se clasifica (5 marzo 2018) SUSTANCIAS PURAS - Elementos, son sustancias puras que no pueden ser descompuestas en otras sustancias puras más sencillas por ningún procedimiento, por ejemplo, los elementos de la tabla periódica como el oxígeno, hierro, calcio, sodio, yodo, carbono, etc. Se los representa con su símbolo químico y se conocen aproximadamente 115 Compuestos son sustancias puras que están formadas por dos o más elementos combinados en proporciones fijas. Los compuestos se pueden separar a través de procedimientos químicos en los elementos que los forman y que tienen propiedades diferentes
- 15. a ellos, por ejemplo el agua, de fórmula H2O (líquida), está constituida por los elementos hidrógeno (gas) y oxígeno (gas) y se puede descomponer en estos elementos mediante la acción de una corriente eléctrica (electrólisis). Mezclas: son la combinación de dos o mas sustancias y se clasifican en: homogeneas y heterogeneas. La materia homogenea es la que presenta una composicion uniforme, en la cual no se pueden distinguir a simple vista sus componentes; en muchos casos, no se distinguen ni con instrumentos como el microscopio. Por ejemplo: el agua, la sal, el aire, la leche, el azucar y el plastico. heterogenea es aquella cuyos componentes se distinguen unos de otros, ejemplos: la madera, el marmol, una mezcla de agua con aceite, o bien de frutas, entre otros.
- 23. La revolución química',1 también conocida como la primera revolución química, es la reformulación de la química basada en la ley de conservación de la materia y la teoría de combustión del oxígeno. El 20 de febrero de 1773, Lavoisier escribió: La importancia del fin que me impulsó a realizar todo este trabajo, parecía destinado a provocar una revolución en química. Lavoisier decía en su teoría de la ley de conservación de la masa que "la masa no se crea ni se destruye solo se transforma". Aunque la obra de experimentadores tan notables como SCHEELE, PRIESTLEY y CAVENDISH condujo a numerosísimos descubrimientos, su interpretación mediante la teoría del flogisto impedía todo progreso en el conocimiento de los fenómenos químicos. Es Antoine Laurent LAVOlSlER (1743-1794) el que destruye la teoría del flogisto al establecer la naturaleza verdadera de la combustión, y que en su obra Tratado elemental de Química, aparecido en 1789, crea las bases de la química moderna que, en consecuencia, ha podido ser considerada como una ciencia francesa. A los 30 años escasos, LAVOISIER, empleando la balanza que fue siempre su más exacto colaborador, muestra de un modo indiscutible que toda combustión en el aire resulta de una Calcina estaño en un vaso cerrado y comprueba que el peso total del vaso no ha cambiado con la calcinación, que el metal transformado en su «cal» (el óxido) ha aumentado de peso, que el peso del aire contenido en el vaso ha disminuido y que el aumento de peso del metal es igual a la disminución de peso del aire. El flogisto ha recibido el golpe de gracia. Repite el experimento con otros metales, y en I777 con mercurio, que le lleva al análisis del aire, estableciendo su composición que fija en 27 % de aire respirable, que llamó despuésoxígeno, Y 73 % de aire no respirable que llamó más tarde «azote» (el nitrógeno). La composición verdadera es 21% de oxígeno Y 79 % de nitrógeno. LAVOISIER establece la noción precisa de cuerpo puro al demostrar que la destilación repetido del agua no cambia sus propiedades, adopta el concepto de elemento de BOYLE, pero lo basa en el resultado experimental, halla la composición del agua, no sólo por síntesis sino por análisis, y da al aire inflamable de CAVENDISH el nombre de hidrógeno (engendrador de agua) y piensa que todos los ácidos contienen oxígeno (que significa engendrador de ácidos), pues si bien se conoce el ácido muriático (el ácido clorhídrico) se le cree un ácido oxigenado. En todas sus investigaciones utiliza sistemáticamente el principio de la conservación de la materia, «nada se pierde, nada se crea», del que en realidad no fue autor ya que era aceptado implícitamente por otros químicos y que debe atribuirse al médico y químico francés Jean REY (1583-1645), que estudió también la calcinación de los metales y, al atribuirla al aire, fue un precursor de LAVOISIER. La revolución química producida por las ideas de LAVOISIER condujo a una nueva nomenclatura, que hoy nos parece tan natural, en la que los nombres de los cuerpos dan idea de su constitución. Esta labor fue debida, junto a LAVOISIER, a Guyton DE MORVEAU, BERTHOLLET y FOURCROY, que publicaron en 1787 su obra Método de nomenclatura química, en la que se introducen nombres que aún se utilizan.
- 24. En la actualidad Un átomo es la porción mas pequeña de materia que puede reaccionar quimicamente. Cualquier objeto que puedas ver en este momento (el monitor, el mouse, el teclado, etc.) está formado por átomos. Estructura atómica Los átomos poseen un núcleo y orbitas que lo rodean. Dentro del núcleo se concentran los protones(p+) y los neutrones(n), mientras que girando alrededor de éste, en las orbitas, se encuentran los electrones(e-). El modelo es fácilmente comparable con nuestro sistema solar, donde el núcleo vendría a ser el sol, y los electrones los planetas, girando en orbitas alrededor del núcleo. (La comparación es simplemente para dar una idea, pero el modelo atómico difiere mucho del sistema solar) Los protones poseen carga positiva, los neutrones, como lo dice la palabra, son neutros, y los electrones son negativos. En un átomo la cantidad de protones y electrones es la misma, por lo que el átomo es neutro. El Numero Atómico (Z) de un átomo nos muestra la cantidad de protones que éste posee (que, obviamente, coincide con la cantidad de electrones). El Número Másico (A) nos muestra la cantidad de neutrones y protones de un átomo. Éste coincide con la masa atómica. Entonces... si queremos saber el número de neutrones que posee un átomo: A-Z Según la cantidad de electrones, protones y neutrones que tiene un átomo, podemos encontrar distintos elementos. Por ejemplo, si un átomo tiene un electrón, y un protón, tenemos un átomo de Hidrogeno. Ahora, si a ese átomo le agregamos un protón, un electrón, y dos neutrones mas, tenemos un átomo de otro elemento, el Helio. En la tabla periódica cada elemento esta representado por un símbolo, y por un numero. Por ejemplo, el Hidrógeno está representado por el símbolo H y por el numero 1. Este número es el anteriormente denominado Número Atómico o Z.
- 25. Modelos atomicos Modelo atomico de Dalton Fue el primer modelo atómico y postulaba lo siguiente: La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir. Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes. Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas. Los átomos, al combinarse para formar compuestos guardan relaciones simples. Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto. Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos. desapareció ante el modelo de Thomson ya que no explica los rayos catódicos, la radioactividad ni la presencia de los electrones y protones. Modelo de Thomson Luego del descubrimiento del electrón en 1897 por Joseph John Thomson, se determinó que la materia se componía de dos partes, una negativa y una positiva. La parte negativa estaba constituida por electrones, los cuales se encontraban según este modelo inmersos en una masa de carga positiva a manera de budín de pasas. Modelo de Rutherford Este modelo fue desarrollado por el físico Ernest Rutherford, a diferencia del anterior, POSTULA QUE LA PARTE POSITIVA SE CONCENTRA EN UN NÚCLEO, EL CUAL TAMBIÉN CONTIENE VIRTUALMENTE TODA LA MASA DEL ÁTOMO, MIENTRAS QUE LOS ELECTRONES SE UBICAN EN UNA CORTEZA ORBITANDO AL NÚCLEO EN ÓRBITAS CIRCULARES O ELÍPTICAS CON UN ESPACIO VACÍO ENTRE ELLOS.
- 26. Por desgracia, el modelo atómico de Rutherford presentaba varias incongruencias: Contradecía las leyes del electromagnetismo de James Clerk Maxwell, las cuales estaban muy comprobadas mediante datos experimentales. Según las leyes de Maxwell, una carga eléctrica en movimiento (en este caso el electrón) debería emitir energía constantemente en forma de radiación y llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría. Todo ocurriría muy brevemente. No explicaba los espectros atómicos. Modelo de Bohr Para NIELS BOHR “El átomo es un pequeño sistema solar con un núcleo en el centro y electrones moviéndose alrededor del núcleo en orbitas bien definidas.” Las orbitas están cuantizadas (los e- pueden estar solo en ciertas orbitas) Cada orbita tiene una energía asociada. La más externa es la de mayor energía. Los electrones no radian energía (luz) mientras permanezcan en orbitas estables. Los electrones pueden saltar de una a otra orbita. Si lo hace desde una de menor energía a una de mayor energía absorbe un cuanto de energía (una cantidad) igual a la diferencia de energía asociada a cada orbita. Si pasa de una de mayor a una de menor, pierde energía en forma de radiación (luz). Modelo de Schrödinger: modelo actual se abandona la concepción de los electrones como esferas diminutas con carga que giran en torno al núcleo, que es una extrapolación de la experiencia a nivel macroscópico hacia las diminutas dimensiones del átomo. En vez de esto, Schrödinger describe a los electrones por medio de una función de onda, el cuadrado de la cual representa la probabilidad de presencia en una región delimitada del espacio. Esta zona de probabilidad se conoce como orbital. La gráfica siguiente muestra los orbitales para los primeros niveles de energía disponibles en el átomo.
- 27. ELEMENTOS QUÍMICOS O CUERPOS SIMPLES Todo cuanto constituye la materia y conforman las diferentes sustancias puede dividirse en dos grandes grupos: LAS SUSTANCIAS ELEMENTALES Y LOS COMPUESTOS entendiendo que los compuestos se obtienen por la combinación de sustancias elementales. Una sustancia elemental es aquella que está constituida por átomos de una sola clase o de la misma naturaleza y se le denomina elemento químico o también cuerpo simple, un compuesto es en cambio aquella sustancia que se encuentra constituida por átomos de dos o más clases diferentes de naturaleza distintas sujetándose a principios de proporcionalidad ya determinada. Elemento químico o cuerpo simple. Ejemplo: C = Cloro O = Oxígeno Al = Aluminio Compuesto químico. Ejemplo. H2 O = Agua: 2 hidrógenos y 1 Oxígeno. ClNa = Cloruro de Sodio: 1 Cloro y 1 Sodio. Al (OH)2 = Hidróxido de aluminio: 1 aluminio, 2 oxígenos y 2 hidrógenos. NATURALEZA DE LOS ELEMENTOS QUIMICOS Según Aristóteles en la naturaleza existían cuatro elementos fundamentales LA TIERRA, EL MAR, EL AGUA y EL FUEGO, nombre que se les utiliza probablemente para representar los ESTADOS SÓLIDO, LIQUIDO y GASEOSO y EL ESTADO DE INCANDESCENCIA O CONBUSTIÓN DE LA MATERIA. En la actualidad esta concepción de Aristóteles está muy lejos de las actuales investigaciones en Química, pues parecía que antiguamente se pretendía simplificar el estado de la naturaleza. Existen pues las pruebas de que el ORO, COBRE, HIERRO, PLOMO y el ESTAÑO, fueron ya conocidos por el hombre unos 3000 A.C. y que el ARSENICO, EL ANTIMONIO y EL MERCURIO, fueron descubiertos antes del año 1500 A.C. en la biblioteca de San Marcos en Valencia España, se conserva el manuscrita de un alquimista del siglo II de nuestra era, la cual los metales se identificaban con cuerpos celestes. EL ORO.- Con el Sol. LA PLATA.- Con la Luna o la que se llama Diana. EL PLOMO.- Con el Saturno. EL HIERRO.- Con Marte. EL COBRE.- Con Venus ya que era extraída de CHIPRE, ya que se adoraba al Dios Venus. EL ESTAÑO.- Con Mercurio. EL ELECTRO.- Con Júpiter. EL MERCURIO.- Se llama así por las supuestas relaciones con dicho planeta.
- 28. En conclusión podemos manifestar que los elementos químicos conocidos desde la antigüedad pero no en la forma extremadamente se los tiene sino como algo que forma parte del mundo natural. SU PRESENCIA EN EL MUNDO MATERIAL Todos los elementos químicos se encuentran en la naturaleza ya sea en estado libre, conformando los yacimientos o combinando con otros elementos. El número de estos elementos han ido creciendo año tras año por nuevos descubrimientos e investigaciones. El tiempo es el siguiente. Anteriormente hasta 3000 A.C. se conocían 6 elementos. Hasta 1500 años A.C. se conocían ya 9 elementos. En la época de Mendeleyev, en 1883 se habla ya de 63 elementos. En el año 1954 se anunció el descubrimiento del elemento 100 En la actualidad se habla ya de 105 elementos y se anuncia el descubrimiento de otros elementos que se encuentran en proceso de confirmación. NOMENCLATURA O NOMBRE DE LOS ELEMENTOS QUÍMICOS Para la denominación concreta que permite distinguir un elemento de otro se aplicaron las siguientes reglas. La influencia del latín y el griego han sido notorios, también en la estructuración de las ciencias dentro de la química por esta razón a los elementos químicos se dieron nombres en el latín y el griego que más tarde fueron traducidos al español. Ejemplo: Ferrum = Hierro, Cuprum = Cobre, Aurum = Oro, etc. Como segunda regla fue, darles el nombre del lugar, ya sea del descubrimiento o del lugar donde existe una mayor cantidad, por ejemplo: Plutonio en honor a Plutón; Uranio recuerda al planeta Urano; Europio en honor a Europa, etc. La tercera regla consistía en la asignación del nombre del descubridor o investigador que condujo a su conocimiento, por ejemplo: Einstenio, en honor a Einstein; Mendelevio, en honor a Mendeleyev; Rutenio, que recuerda a Rutherford, etc. También se adoptó como regla la adjudicación de un nombre de acuerdo al significado de cada elemento; por ejemplo, Hidrógeno, que significa generador de agua.
- 29. En esta forma se fueron dando el nombre a los elementos químicos para poder diferenciar unas de otras y facilitando así el estudio de la química. Clasificación de lo elementos en la Tabla Periódica Los elementos en la tabla periódica se clasifican en metales, no metales y gases inertes. LOS METALES: Cuerpos simples que tienen la tendencia a ceder electrones de la órbita periférica transformándose en un ión positivo y como tal suele encontrarse en los compuestos. En estado natural, muy raramente los metales se encuentran puros, pues generalmente se encuentran combinados con el oxígeno o con otros elementos, especialmente con el azufre. El metal mas difundido en la corteza terrestre es el Al, seguida por el Fe, Ca, el Na el K y el Mg, en su orden, los restantes se encuentran en proporciones mínimas. Entre las principales propiedades de los metales se encuentran: - Poseen brillo, característico o brillo metálico. Maleabilidad, la capacidad del metal para ser batidos y extendidos en planchas o láminas propiedad que aumenta con el calor. Ductivilidad, capacidad para ser estirados y reducidos a hilos muy delgados. Conductibilidad, capacidad para conducir el calor y la electricidad. Los metales se encuentran a la izquierda en la tabla periódica, son buenos conductores del calor y la electricidad. En sus mayorías son sólidos, excepto algunos (Como el mercurio o el galio), que son líquidos. LOS NO METALES: Son elementos químicos que tienen la tendencia a capturar electrones de otros átomos para transformarse en iones negativos. Entre las propiedades más importantes tenemos: No poseen brillo metálico. Son malos conductores del calor y la electricidad. Su peso específico es bajo. No son maleables, esto es, no se pueden reducir a láminas ya que ante una presión o golpe de martillo se vuelven quebradizos. Tampoco son dúctiles, es decir, no se prestan para reducirlos a hilos delgados. Son aislantes Pueden ser sólidos como el Carbono, líquidos como el Boro o gases como el Oxígeno. Algunos no metálicos a la temperatura ordinaria son sólidos, como el C y el Si, etc, otros son líquidos como el Boro y otros gases, como el Cloro.Existen un total de 22 no metales. Tienen propiedades intermedias entre los metales y los no metales. - El Silicio por ejemplo es un semi metal que tiene brillo, pero no es maleable ni dúctil, sino que es quebradizo como muchos no metales. Además es menos un mal conductor de la electricidad y el calor.
- 30. - Los semi metales se usan muy a menudo en la industria de los semiconductores (diodos, procesadores, memorias de computadoras, etc.). SEMIMETALES: - Divisiones en la tabla periódica Estructuralmente, la tabla periódica se divide en segmentos verticales y segmentos horizontales llamados grupos y períodos respectivamente. En la tabla hay 18 grupos. Todos los elementos de un mismo grupo tienen la misma cantidad de electrones en su última orbita. Hay grupos A, donde encontramos los elementos representativos, grupos B, donde vemos elementos de transición y grupos sin letra, donde se hallan los elementos de transición interna. En los grupos A el número de grupo coincide con los electrones de la última orbita, en los grupos B, el número de grupo coincide con el estado de oxidación (carga que utilizan para reaccionar químicamente) mayor. Los
- 31. períodos indican la cantidad de orbitas o niveles energéticos que poseen los átomos. Períodos En la tabla periódica los elementos están ordenados de forma que aquellos con propiedades químicas semejantes, se encuentren situados cerca uno de otro. Los elementos se distribuyen en filas horizontales, llamadas períodos. Pero los periodos no son todos iguales, sino que el número de elementos que contienen va cambiando, aumentando al bajar en la tabla periódica. El primer periodo tiene sólo dos elementos, el segundo y tercer periodo tienen ocho elementos, el cuarto y quinto periodos tienen dieciocho, el sexto periodo tiene treinta y dos elementos, y el séptimo no tiene los treinta y dos elementos porque está incompleto. Estos dos últimos periodos tienen catorce elementos separados, para no alargar demasiado la tabla y facilitar su trabajo con ella. El periodo que ocupa un elemento coincide con su última capa electrónica. Es decir, un elemento con cinco capas electrónicas, estará en el quinto periodo. El hierro, por ejemplo, pertenece al cuarto periodo, ya que tiene cuatro capas electrónicas. Estructura o Configuración Electrónica Ya sabemos que los electrones se encuentran alrededor del núcleo pero, ¿donde exactamente? Se encuentran en orbitas o capas. En total son 8 capas, según la cantidad de elementos conocidos. Estas capas se llaman, según la proximidad al núcleo, k, l, m, n, o, p, q, r; donde k es la mas cercana y r la mas lejana. Período 1 (2 elementos) Período 2y 3 (8 elementos) Período 4 (18 elementos) Período 6 (32 elementos)
- 32. A su vez, estas capas están divididas en subcapas o subniveles. Estos se llaman s, p, d, f. En el subnivel s se pueden albergar dos electrones, en el subnivel p 6, en el subnivel d 10 y en el f 14 electrones. Bien... en la primer capa solo hay un subnivel el 1s, en la segunda capa hay dos: el 2s y el 2p. Luego, en la tercera, encontramos los subniveles 3s, 3p y 3d. En la siguiente imagen se puede apreciar la cantidad de capas, de subniveles que hay en cada capa, la cantidad de electrones que entran en cada subnivel y en cada capa. Además, nos muestra el orden de llenado de las capas y los subniveles, ya que este no es aleatorio. Este orden es indicado por las flechas: primero se llena el subnivel 1s, luego el 2s, y así como lo muestra el gráfico. Sabiendo esto, podemos decir que el Hidrógeno, que tiene un electrón, lo alberga en el subnivel 1s, y el Helio, que tiene dos electrones, completa ese subnivel y esa capa. Luego el Litio llena el subnivel 1s y tiene un electrón en el 2s. Así todos los elementos, según la cantidad de electrones que posean, van llenando sus capas en el orden indicado por el gráfico anterior. Formación de Cationes y Aniones Como ya sabemos, todos los elementos que nos muestra la tabla periódica se encuentran con carga neutra porque tienen electrones y protones en igual cantidad. Pero, ¿que pasa si un átomo pierde o gana un electrón?Constantemente en la naturaleza se producen innumerables reacciones químicas, en las que algunos átomos ceden electrones, y otros los toman. Cuando un átomo cede electrones se forma un catión, que es positivo. Por ejemplo, si el magnesio, que en su estado neutro tiene 12 protones y 12 electrones, cede 2 electrones, se forma un catión magnesio con carga +2: 12 protones y 10 electrones. Ahora... en el proceso inverso, si un átomo toma electrones, forma un anión, que tiene carga negativa, ya que el numero de electrones será mayor al numero de protones. Estos procesos se denominan Oxidación y Reducción respectivamente. Cabe destacar que los electrones que se ganan y se ceden son los que se encuentran mas alejados del núcleo, ya que el núcleo posee menor poder de atracción sobre ellos. Además es
- 33. importante tener en cuenta que los iones y los camiones se forman solo por la ganancia y perdida de electrones, y el numero de protones no se modifica. Para que el núcleo del átomo se modifique deben ocurrir fenómenos de radioactividad o reacciones nucleares. Las uniones covalentes se establecen entre dos o mas no metales. La diferencia de electronegatividad entre los elementos es pequeña, por lo que se comparten los e-. ejemplo:
- 34. SEGUNDA REVOLUCIÓN QUIMICA Fue un tiempo en el que hubo grandes adelantos lo que dio origen a la "Tabla Periódica". ¿Qué ocurrio en la segunda revolucion quimica? 1. ROBERT BOYLE En la ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante. Robert Boyle 2. JONS JACOB BERZELIUS fue quién propuso los nombres de litio y vanadio, así como el de sodio. Descubrio el torio, el cerio y el selenio. Fue el primer químico que aisló el silicio (en 1823), el circonio (en 1824), el torio (en 1828) y el titanio. Estudió las combinaciones de azufre con fósforo, el flúor y los fluoruros, determinó un gran número de equivalentes químicos. Jöns Jacob Berzelius 3. STANISLAO CANNIZZARO (1826-1910) El problema de la determinación de los pesos atómicos quedó resuelto en 1858 por quien el quien reafirmó el concepto de molécula propuesto anteriormente por Avogadro.
- 35. 4. AUGUST KEKULE El trabajo más conocido de el, se centró en la estructura del benceno es muy conocida la manera en la que descubrió la estructura en anillo del benceno, tras una visión en sueños de una serpiente mordiéndose la cola. En 1865, Kekulé publicó un artículo en francés en el que sugería que la estructura contiene un anillo de átomos de carbono de seis miembros con enlaces simples y dobles alternados August Kekulé 5. JULIUS LOTHAR MEYER En un artículo publicado en 1870 presentó su descubrimiento de la ley periódica que afirma que las propiedades de los elementos son funciones periódicas de su masa atómica. Esta ley fundamental fue descubierta en 1869 por el químico ruso Dimitri Mendeléyev, quien fue mas reconocido por el hallazgo que su colega Meyer. 6. JOHANN WOLFGANG DÖBEREINER Descubrió tendencias en ciertas propiedades de grupos seleccionados de elementos. Por ejemplo, la masa atómica media de litio y potasio estaba cerca de la masa atómica de sodio. Un patrón similar se encontró con el calcio, estroncio y bario, con azufre, selenio, y telurio, y también con cloro, bromo, y yodo.
- 36. 7. JOHN NEWLANDS Preparó en 1864 una tabla periódica de los elementos establecida según sus masas atómicas, y que señaló la ley de las octavas según la cual cada ocho elementos se tienen propiedades similares. 8. DMITRI MENDELÉYEV Fue un químico ruso, célebre por haber descubierto el patrón subyacente en lo que ahora se conoce como la tabla periódica de los elementos.
- 37. Conceptos e importancia La materia puede sufrir cambios físicos, químicos y nucleares. Los cambios químicos suceden mediante las reacciones químicas, y estas se representan mediante las ecuaciones químicas. Las reacciones químicas suceden a cada segundo y en todo el universo. Las mismas tienen di- versas importancias y pueden ser de diferentes tipos; estas reacciones suceden en el aire, en el suelo, en los vegetales, en los animales, en los humanos, en la cocina, en automóviles, etc. Son ejemplos de reacciones químicas la respiración, la fotosíntesis, el metabolismo, la reproducción, el crecimiento, la formación de óxidos, de hidróxidos, de ácidos, de sales, de rocas y suelo, etc. Sin embargo, para que se realice una reacción química es necesaria la presencia de una o más sustancias, para que se descomponga o se combinen y así formar las o la nueva sustancia. - Conceptos de reacción química. * Son los cambios, reacomodos o reorganizaciones que sufren los átomos de las sustancias o elementos que se combinan para producir nuevas sustancias. * Es el rompimiento de viejos enlaces químicos para formar nuevos enlaces, y así nuevas sustancias. * Es el proceso mediante el cual una o más sustancias combinadas se transforman en otra u otras, con propiedades diferentes. * Proceso en el que a partir de una o mas sustancias se originan otras nuevas. - Importancia de las reacciones químicas. Hablar de reacciones químicas es hablar de cambios, los cuales suceden a cada momento y en todas partes, por lo que su estudio es de vital importancia. Entre las importancias están: * Mediante ellas se producen nuevos compuestos, como medicinas. * Los seres se mantienen vivos gracias a ellas, es el caso de la digestión, la fotosíntesis y la respiración. * En el medio ambiente ocurre la combustión (el fuego para diversos usos).
- 38. Representación de las reacciones químicas En realidad, las reacciones químicas no se pueden ver a simple vista, es decir, el hombre no puede ver los cambios que suceden al momento de combinar dos o más sustancias, pero si sabe lo que sucede, y, por lo tanto, puede escribir tales cambios mediante una ecuación química. Una ecuación química es " la representación gráfica (por escrito) de una reacción química", es decir, las reacciones químicas se representan por medio de las ecuaciones químicas, mismas que están formadas por varias partes, las que se agrupar de dos maneras: a. Reactivos y productos. Las sustancias que se combinan se llaman reactivos, y se localizan a la izquierda de la ecuación; y a las sustancias que resultan de tal combinación se les nom - bra productos(sustancias nuevas), localizadas a la derecha de la ecuación. Por ejemplo, cuando el Hidrogeno se combina con Oxigeno(reactivos) reaccionan y originan una nueva sustan cia llamada agua (producto);esta reacción química se puede representar mediante una ecuación química denominada ecuación del agua, así: Observe que los reactivos siempre se colocan a la izquierda de la flecha (que significa "se origina o produce"), y los productos a la derecha de la misma. Otro ejemplo de ecuación es la del óxido de magnesio: b. Símbolos y números. Otra manera de dividir a las partes de una ecuación es en símbolos y números. En una ecuación existen tres tipos de símbolos: En cuanto a los números, existen dos tipos de ellos en una ecuación: - Enteros y grandes, llamados coeficientes.
- 39. - Enteros y pequeños, llamados sub-índices. El coeficiente es el número grande que va situado por delante de todos los símbolos de una formula, e indica la cantidad de moléculas de la sustancia de que se trate; cuando no aparece un coeficiente en la fórmula es porque se supone que es uno (1), el cual no se escribe, lo que también se aplica para el sub-índice. Cuando el coeficiente se multiplica por el sub-índice resulta el total de átomos del elemento químico que lo lleva en la formula, esto es que, el coeficiente afecta a todos los sub-índices de una formula. Respecto al sub-índice, este es un número pequeño que se localiza en la parte inferior derecha de cada símbolo químico e que indica la cantidad de átomos del elemento. Así mismo, cuando en el símbolo químico no aparece el sub-índice es porque se supone que es uno(1), el cual no se escribe. Observe los símbolos y números en la siguiente ecuación del agua: a. La o las nuevas sustancias que se forman (productos) suelen presentar un aspecto totalmente diferente del que tenían las sustancias originales (reactivos). b. Durante las reacciones se desprende o se absorbe energía, por lo que estas pueden dividirse en exotérmicas (desprenden energía en el curso de la reacción), y endotérmicas (absorben e- nergía durante el curso de la reacción). c. Se cumple la ley de conservación de la masa: "la suma de las masas de los reactivos es igual a la suma de las masas de los productos". Esto es así porque durante la reacción los átomos ni aparecen ni desaparecen, sólo se reordenan para formar las nuevas sustancias. d. Las reacciones alteran la estructura interna de los reactivos. Clasificación de las reacciones químicas (tipos) Todas las reacciones químicas existentes se pueden clasificar de diversas maneras, por ejemplo, algunos autores las clasifican en dos grandes grupos: reacciones de neutralización (acido -base) y reacciones de oxidación-reducción (redox); otros autores las clasifican en un solo grupo como reacciones generales, y así existen otras clasificaciones. He aquí todos estos grupos de re - acciones: a. Reacciones de energía. Estas son de dos tipos: - Reacciones exotérmicas. Son aquellas que liberan o pierden calor, por ejemplo las reacciones de combustión, que por desprender energía se utilizan como fuente de esta. En la combustión los reactivos son el combustible y el oxígeno del aire, y los productos suelen ser, aunque no siempre, dióxido de carbono y vapor de agua. Ejemplos:
- 40. Otros ejemplos de reacciones que desprenden energía o calor son: el paso de gas a líquido (condensación) y el paso de líquido a solido (solidificación). - Reacciones endotérmicas. Estas reacciones necesitan calor para que se lleven a cabo. En ellas los productos tienen más energía que los reactivos. Un ejemplo de reacción endotérmica es la producción del ozono (O3). Esta reacción ocurre en las capas altas de la atmósfera, en donde las radiaciones ultravioleta proveen la energía del Sol. También ocurre cerca de descargas eléctricas (cuando se producen tormentas eléctricas). Hornear pan, calentar una tortilla y hervir agua requieren de energía (calor). b. Reacciones de proceso. Que pueden ser de dos tipos: - Reacciones reversibles. Son aquellas en donde los productos que se forman pueden regresar a sus estados o sustancias originales (reactivos). Este concepto está plasmado en aquellas ecuaciones que presentan dos flechas en sentido opuesto. - Reacciones irreversibles. Los productos que se forman no pueden volver a sus estados o sustancias originales. c. Reacciones de velocidad. Se clasifican en: - Reacciones rápidas. En estas se forma una elevada cantidad de producto, en relación al tiempo en que se realizó la reacción. - Reacciones lentas. La cantidad de producto formado es muy pequeña, siempre en relación al tiempo. d. Reacciones REDOX. Son aquellas en las que algunos elementos químicos cambian su número de oxidación. Dicho de otro modo, una de las sustancias a combinar perderá o cederá electrones y la otra sustancia a combinar los ganara o aceptara tales electrones. Por lo tanto, estas reacciones son de dos tipos:
- 41. e. Reacciones de enlace. - Reacciones iónicas. En la combinación de sustancias hay ganancia y pérdida de electrones. - Reacciones covalentes. Las sustancias combinadas comparten sus electrones. f. Reacciones generales. Es la clasificación más utilizada, y pueden ser: - Reacciones de síntesis o combinación. Es cuando dos o más elementos y/o sustancias se combinan para formar una nueva sustancia y más compleja. - Reacciones de descomposición. Una sustancia compleja se descompone en las sustancias simples que la forman. - Reacciones de desplazamiento sencillo. Una sustancia simple reacciona con una sustantancia compleja, provocando en esta la separación de uno de sus componentes. En otras palabras, un elemento químico libre sustituye a otro que está formando parte de un compuesto.
- 42. - Reacciones de doble desplazamiento. Dos sustancias compuestas o complejas reaccionan entre si, provocándose la separación e intercambio de alguno de sus componentes. Es decir, dos sustancias complejas intercambian elementos químicos. Cuadro resumen de las reacciones químicas generales. Nombre Descripción Representación Reacción de síntesis Elementos o compuestos sencillos se unen para formar un compuesto más complejo. A+B ? AB Reacción de descomposición Un compuesto se fragmenta en elementos o compuestos más sencillos. AB ? A+B Reacción de desplazamiento simple Un elemento reemplaza a otro en un compuesto. A + BC ? AB + C Reacción de doble desplazamiento Los iones en un compuesto cambian lugares con los iones de otro compuesto para formar dos sustancias diferentes. AB + CD ? BC + AD La energía de las reacciones El hombre ha utilizado las reacciones químicas para producir energía; por ejemplo, utiliza la combustión de madera o de carbón, invento los motores de explosión de los coches, llegando hasta las más sofisticadas, que tienen lugar en los motores de propulsión de las naves espaciales. Figura 1 Se sabe que las reacciones químicas van acompañadas en unos casos de un desprendimiento de energía, y en otros de una absorción de la misma. En el primer caso se denominan reacciones exotérmicas y en el segundo caso reacciones endotérmicas; así, las reacciones implican un
- 43. intercambio de energía con su medio. La energía de cualquier sustancia química está formada por su energía cinética y potencial, y es - tas están localizadas en sus partículas constituyentes: átomos, electrones y núcleos. Por tanto, se puede afirmar que los reactivos de una re acción química poseen cierta cantidad de energía propia (energía in - terna), y que los productos poseen otra cantidad diferente. Figura 2 La energía desprendida o absorbida puede ser en forma de energía luminosa, eléctrica, etc., pero habitualmente se manifiesta en forma de calor, por lo que el calor desprendido o absorbido en una reacción química se llama calor de reacción y tiene un valor característico para cada reacción, en unas determinadas condiciones de presión y temperatura. Para llevarse a cabo, muchas reacciones químicas absorben energía de la luz solar como es el caso de la fotosíntesis, que es catalogada como una reacción endotérmica. En general, si el lugar donde se lleva a cabo una reacción química esta frio, luego esta reacción absorbió la energía del medio; si por el contra rio el lugar está caliente, entonces la reacción desprendió calor. Figura 3 Velocidad de reacción En la mayoría de los casos interesa acelerar las reacciones químicas, como por ejemplo en la fabricación de productos, en la curación de heridas o enfermedades, en la maduración de los frutos, en el crecimiento de las plantas, etc. Pero existen casos en que interesa retardar las reacciones químicas, para el caso,
- 44. la corrosión de los materiales de hierro y otros metales, en la descomposición de alimentos, en el retraso de la caída del cabello y de la vejez, etc. Las industrias se interesan grandemente en que las reacciones químicas se lleven a cabo rápidamente, para así ahorrar tiempo y dinero. La Química estudia este aspecto, el de la velocidad de las reacciones, mediante una de sus ramas llamada cinética química. Una reacción química necesita tiempo para que se lleve a cabo. Cuando se combinan 2 o más sustancias, estas pueden reaccionar en forma rápida o lenta para formar los productos o las sustancias nuevas, por lo cual las reacciones se dividen también en reacciones rápidas y reacciones lentas. En base a lo anterior, surge el término de tiempo de reacción, que se define como el tiempo en el que transcurre una reacción química. La velocidad de una misma reacción química varia conforme avanza el tiempo, es decir, la ve locidad no es constante, no es la misma durante se lleva a cabo la reacción. Ahora bien, si relacionamos el tiempo de la reacción con las cantidades de los reactivos y productos, entonces resulta un nuevo concepto: el de velocidad de reacción, el que se define de las maneras siguientes: - Es la velocidad a la que se forman los productos en una reacción química. - Es la velocidad a la que se gastan los reactivos en una reacción química. - Es la cantidad de una sustancia que se transforma en una reacción química en la unidad de tiempo. Lo anterior significa que, en una reacción química una cierta cantidad de reactivos produce otra cierta cantidad de productos en menor o mayor tiempo, lo cual depende de la velocidad con que se lleve a cabo la reacción. La reacción se califica de rápida cuando los reactivos se gastan o consumen en menos tiempo, o bien cuando los productos se forman de prisa. Son ejemplos de reacciones rápidas y lentas las siguientes: - Un trozo de carne se descompone rápidamente a temperatura ambiente, y lentamente en la refrigeradora. - Los materiales de hierro se oxidan más rápido que los materiales de aluminio. - La formación de agua es más rápida que la del petróleo. - Ocurre más rápido la formación de óxido de sodio (Na2O) que la de óxido de hierro (Fe2O3). - La combustión de un pedazo de papel sucede más rápido que la digestión humana. Científicamente se ha demostrado que una reacción, ya sea rápida o lenta (velocidad de reacción), se ve afectada o depende de cuatro situaciones: la naturaleza de los reactivos, concentración de los reactivos, la temperatura y de la presencia de catalizadores. - Naturaleza de los reactivos. Esto se refiere a la capacidad que tiene una sustancia para combinarse con otra y así formar nuevas sustancias, o bien, a la facilidad con que una sustancia se descompone en otras más simples. Las sustancias gaseosas reaccionan más rápido que los liquidos y los sólidos, en este orden. Así mismo,
- 45. las sustancias que presentan enlaces iónicos reaccionan más rápido que aquellas que presentan enlaces covalentes. Las reacciones iónicas se efectúan inmediatamente, debido a las frecuentes colisiones entre los iones con cargas opuestas. - Concentración de los reactivos. Se entiende por concentración a la cantidad de sustancia existente en un determinado volumen. Por ejemplo, en un litro de agua existen 2 gramos de azúcar de mesa, y en otro litro de agua existen 50 gramos de la misma sustancia; en este último caso la concentración de azúcar es mayor, pues hay una mayor cantidad de esta sustancia por litro de agua (volumen). En muchas reacciones, las distintas sustancias que intervienen (reactivos y productos) suelen formar una mezcla homogénea, cuya cantidad se puede medir en unidades de nominadas mol. En la mayoría de los casos una reacción química aumenta su rapidez al incrementarse la concentración de uno o más de sus reactivos. Al aumentar la concentración de un reactivo aumenta también el número de sus partículas (moléculas) en el medio de la reacción. La velocidad es mayor al comienzo de la reacción, pues hay una mayor concentración de reactivos, pero cuando estos disminuyen con el tiempo entonces disminuye la velocidad de reacción; por lo tanto, a mayor concentración de los reactivos se mejora la rapidez de la reacción. "La velocidad de una reacción química es proporcional a la concentración en moles por litro (moles/litro), de las sustancias reaccionantes". Esto significa que, si duplicamos la concentra - ción de los reactivos entonces la velocidad de la reacción se duplica. Así mismo, al aumentar la presión en dos sustancias gaseosas que van a reaccionar entonces se aumenta su concentración y por lo tanto se aumenta la velocidad de reacción. - Temperatura. Se dice que "la velocidad de una reacción crece, en general, con la temperatura y se duplica, aproximadamente, por cada 10 °C que aumenta la temperatura". En forma breve, al incrementarse la temperatura se aumenta la velocidad de las reacciones químicas. Figura 4 Por ejemplo, el cloruro de sodio reacciona lentamente con el ácido sulfúrico; si se le proporciona calor aumenta la velocidad de reacción dando sulfato de sodio (Na2SO4) y ácido clorhídrico: Otro ejemplo, el hidrógeno y el oxígeno pueden mantenerse durante años en el mismo recipien te sin reaccionar. Pero si la mezcla se calienta a 800 °C, o se introduce una llama o una chispa en el recipiente, el hidrógeno y el oxígeno reaccionan violentamente. Esto es que, la temperatura au
- 46. menta el movimiento (velocidad) de las moléculas de estas dos sustancias, y por lo tanto aumen- ta el choque continuo entre ellas, o sea, aumentan las colisiones, lo que hace que los reactivos se rompan o se descompongan para luego recombinarse, y de esta manera formar las nuevas sustancias llamadas productos. Ahora bien, el efecto de la temperatura sobre una reacción es mucho mayor a temperatura baja que a temperatura alta. Para el caso, si a las reacciones exotérmicas se les eleva su temperatura entonces se desmejora el equilibro químico de estas reacciones, hasta incluso se puede detener tal reacción. Sin embargo, en las reacciones endotérmicas aumentar la temperatura favorece a la reacción. En conclusión, el incremento en la temperatura favorece a las reacciones endotérmicas y no a las exotérmicas. - Presencia de catalizadores. Un catalizador es una sustancia que modifica la rapidez de una reacción química sin que ella misma se consuma en el proceso o sufra algún cambio químico. Otra definición es: los catalizadores son sustancias que, añadidas en pequeña cantidad, modifican la velocidad de una reacción sin experimentar ningún cambio y sin que se modifique la cantidad de producto formado. En pocas palabras, un catalizador es una sustancia que acelera o retarda una reacción química. Los catalizadores que aceleran las reacciones se denominan catalizadores positivos, y los que las retardan se llaman catalizadores negativos. En ninguno de los dos casos los catalizadores se modifican o sufren cambios, y el proceso se nombra como catálisis. Los catalizadores solo ayudan a que la reacción se lleve a cabo con mayor o menor rapidez; sin embargo, las reacciones químicas pueden ocurrir sin la presencia de catalizadores. Los catalizadores pueden ser de origen orgánico e inorgánico; en el primer caso están las enzimas y los ribosomas (ácidos ribonucleicos), y en el segundo caso están el platino, níquel, cobalto, cobre, etc. 1. COMPUESTOS BINARIOS CLASIFICACIÓN óxidos peróxidos hidruros sales binarias hidrurosóxidos básicos óxidos ácidos Hidrácidos metálicos 2. 15. Elementodel sistema + oxígeno = óxido periódico N + O CO 3. 16. COMPUESTOS BINARIOS : ÓXIDOS +1 Son combinaciones del oxígeno con -2 cualquier elemento químico +2, +3 • Óxido básico : es la combinación del oxígeno con un metal.Compuest Sistemática Stock Tradicional o FeO monóxido de hierro óxido de hierro (II) óxido ferroso Fe 2 O 3 trióxido de dihierro óxido de hierro (III) óxido férrico Li 2 O monóxido de dilitio óxido de litio óxido lítico 4. 17. COMPUESTOS BINARIOS: ÓXIDOS -2• Óxido ácido : Se les denominoanhídridos. Es la combinación del +2,+4oxígeno con un no metal. +2,+4,+6Compuesto Sistemática Stock Tradicional SO monóxido de óxido de azufre (II) Anhídrido azufre hiposulfuroso SO 2 dióxido de azufre óxido de azufre (IV) Anhídrido sulfuroso SO 3 trióxido de azufre óxido de azufre (VI) Anhídrido sulfúrico monóxido de óxido de carbono CO Anhídrido carbonoso carbono (II) CO 2 dióxido de óxido de carbono Anhídrido carbónico carbono (IV)
- 47. 5. 18. COMPUESTOS BINARIOS: PERÓXIDOS • P eróxido : Es la combinación de metal con un oxigeno peróxo. Son combinaciones binarias del oxigeno generalmente con un metal. Son derivados de los óxidos que contiene el agrupamiento O-O (peróxo). El número de oxidación del oxigeno es 1, pero se presenta siempre en forma de dimero.• Formulación: se escribe el símbolo del metal consubíndice 2 seguido del grupo peróxo entre paréntesiscon la valencia del metal como subíndice. 6. 19. COMPUESTOS BINARIOS: PERÓXIDOS• Formulación: se escribe el símbolo del metal consubíndice 2 seguido del grupo peróxo entre paréntesiscon la valencia del metal como subíndice.Compuesto Sistemática Stock Tradicional Ca(O 2 ) Monoperóxido de Peróxido de calcio Peróxido cálcico calcio Fe(O 2 ) Monoperóxido de Peróxido de hierro (II) Peróxido Ferroso hierro. Fe 2 (O 2 ) 3 Triperóxido de Peróxido de hierro Peróxido Férrico dihierro (III) 7. 20. FORMULACIÓN 8. 21. -1 COMPUESTOS BINARIOS HIDRUROS Son combinaciones del hidrógeno con cualquier elemento químico • Hidruros : es la combinación del hidrógeno (-1) con un metal.+1 +2 +2, +3 Compuesto Sistemática Stock Tradicional CaH 2 dihidruro de calcio hidruro de calcio hidruro cálcico LiH monohidruro de litio hidruro de litio hidruro lítico FeH 3 trihidruro de hierro hidruro de hierro (III) hidruro férrico SrH 2 dihidruro de estroncio hidruro de estroncio hidruro de estroncico 9. 22. COMPUESTOS BINARIOS : HIDRÁCIDOS • hidruros no metálicos : es la combinación del hidrógeno (+1) con un no metal de los grupos VIA y+1 VIIA. -1 -2Comp. Sistemática Stock Tradicional HF monofluoruro de fluoruro de ácido fluorhídrico hidrógeno hidrógeno HCl monocloruro de cloruro de hidrógeno ácido clorhídrico hidrógeno H 2S monosulf uro de sulfuro de hidrógeno ácido sulfhídrico dihidrógeno H 2 Se monoseleniuro de seleniuro de ácido selenhídrico dihidrógeno hidrógeno 10.23. COMPUESTOS BINARIOS HIDRÁCIDOS -3 -4 -3+1 • Hidruros volátiles (hidruros no metálicos) : es la combinación del hidrógeno (+1) con un no metal de los grupos IIIA, IVA y VA.Comp. Sistemática Stock Tradicional NH 3 trihidruro de nitrógeno hidruro de nitrógeno (III) amoniaco Limpieza, gas gas fumigante incoloro PH 3 trihidruro de fósforo hidruro de fósforo (III) fosfina gas muy AsH 3 trihidruro de arsénico hidruro de arsénico (III) arsina tóxico mineral SbH 3 trihidruro de antimonio hidruro de estibina (III) estibina opaco hidrocarburo CH 4 tetrahidruro de carbono hidruro de metano (IV) metano aumentador de la adhesión SiH 4 tetrahidruro de nitrógeno hidruro de silicio (IV) silano Uso industrias 11.24. COMPUESTOS BINARIOS SALES BINARIAS+1 Son combinaciones de dos elementos, que no son ni el O ni el H. -1 • Sales neutras : son combinaciones -2 de un metal y un no metal .+1 -1 +1, +3 + 2, +4 Compuesto Sistemática Stock Tradicional LiF monofluoruro de fluoruro de litio fluoruro lítico litio AuBr 3 tribromuro de oro bromuro de oro (III) bromuro áurico Na 2 S monosulfuro de sulfuro de sodio sulfuro sódico disodio SnS 2 disulfuro de estaño sulfuro de estaño (IV) Sulfuro
- 48. los ácidos y las bases - La palabra ácido proviene del latín acetum que quiere decir vinagre. - Base o alcalino deriva de la palabra árabe alkali que significa ceniza. ¿Sabías que puedes encontrar ácidos y bases en tu casa? Ejemplos de ácidos en casa (ordenados de más ácido a menos ácido) -Limones -Vinagre - Refrescos - Naranjas - Vino - Tomates - Leche de vaca Ejemplos de bases en casa (ordenado de más básico a menos básico) -Limpiadores de hornos y graseras - Amoníaco (limpiador) - Lavandina (lejía o hipoclorito) - Leche de magnesia (antiácido) -Jabón de manos - Pasta de dientes - Bicarbonato de sodio - Huevos ¿Qué es el PH? El PH es una forma de medir la acidez o alcalinidad (basicidad) de una solución. Por lo general, el PH va de 0 a 14 en disolución acuosa, siendo ácidas las que tiene un PH menor a 7 y alcalinas (básicas) las que lo tienen mayor a 7.
- 49. En la naturaleza encontramos muchas sustancias que son producto de reacciones en las que se utilizan ácidos y bases. Algunas son muy importantes para los seres vivos. Por ejemplo, el ácido carbónico es importante para mantener constante el PH de la sangre. En la siguiente lista se muestran algunas aplicaciones de ácidos y bases inorgánicas: Ácidos H2SO4 (Ácido sulfúrico). Lo encontramos en la lluvia ácida. Es utilizado en fertilizantes, pinturas, detergentes, baterías de automóviles. HNO3 (Ácido nítrico). También está presente en la lluvia ácida. Se usa en fertilizantes, explosivos y colorantes. HCI (Ácido clorhídrico). Está presente en el estómago. Es utilizado en limpieza de diversos materiales. H2CO3 (Ácido carbónico). Podemos encontrarlo en el fango. Es usado en bebidas carbónicas. H3PO4 (Ácido fosfórico). Se utiliza en bebidas carbónicas, fertilizantes y detergentes Bases Ca(OH)2 (Hidróxido de calcio). Se utiliza en pulpa de papel y cemento. Mg(OH)2 (Hidróxido de magnesio). Presente en la leche de magnesia KOH (Hidróxido de potasio). Se utiliza en los jabones líquidos. NaOH (Hidróxido de sodio). Lo encontramos en los limpiadores de hornos y el jabón. ¿Cómo saber si una sustancia es ácida o básica? Existen líquidos que cambian de color cuando entran en contacto con un ácido o una base. Estas sustancias se llaman “indicadores” y algunos de ellos están en la naturaleza. El color que tienen muchas flores, plantas o frutas es debido a que producen unas sustancias con la propiedad de estar coloreadas. El color del repollo colorado, por ejemplo, se debe a una sustancia llamada “antocianina”, que también está presente en muchos otros vegetales como las ciruelas, uvas, frutillas y cebollas coloradas. Sabías que las bebidas cola también pueden ser un poderoso “limpiador” Seguramente han visto que hay un gran número de metales que al estar en contacto con el aire durante mucho tiempo, se oxidan y se les forma una capa de óxido. Y, ¿sabían cómo pueden limpiarlos? Esa capa es muy fácil de eliminar utilizando un ácido. Por ejemplo, con una bebida cola, que no es un ácido en sí, pero posee uno muy potente llamado fosfórico. Las bases también se pueden utilizar como productos de limpieza. Por ejemplo, el hidróxido de sodio se utiliza mucho para limpiar manchas de grasa.
- 50. ¿Ácidos y bases en medicamentos? Muchas veces nos cuesta digerir los alimentos por un exceso de ácido clorhídrico en el estómago. Por lo que muchas veces tomamos medicamentos que se encargan de neutralizar este efecto. Estos medicamentos contienen algunas bases débiles. Algo más: ¿Sabías que la Aspirina es ácido acetilsalicílico? Ácidos y bases en el pelo y la piel ¿Alguna vez escucharon hablar de esa vieja costumbre de enjuagarse el pelo con vinagre? Por lo general los champú que tenemos en casa suelen ser básicos ya que poseen algún jabón o agente de limpieza. En el cabello hay diferentes enlaces que cuando se lava con champú básico se pueden volver débiles. Esto justifica el enjuague con vinagre o jugo de limón (dos sustancias ácidas). Los ácidos fuertes y las bases fuertes son sustancias que se ionizan en agua casi en su totalidad, es decir, prácticamente no quedan moléculas sin disociar; son electrolitos fuertes. Los ácidos y las bases débiles son sustancias que se ionizan en forma limitada en disoluciones acuosas, por lo tanto, estas disoluciones contienen una mezcla de iones y moléculas sin ionizar; son electrolitos débiles. Algunos ejemplos de: Ácidos fuertes: HCl, HNO3HBr y H2SO4. Ácidos débiles: H2CO3, CH3COOH (ácido acético), ácidos nucleicos, HCN y C6H5OH (fenol). Bases fuertes: NaOH y KOH. Bases débiles: NH4OH, Ca(OH)2y aminas. Los indicadores, son sustancias que cambian de color en cierto rango de pH conocido. Por ejemplo, el indicador universal proporciona una gama de colores que va desde el rojo intenso (medio ácido) hasta el morado (medio básico).
- 52. Alimentos Ácidos y Álcalinos Porque la alimentación es lo más importante Saltar al contenido. Inicio Alimentosácidosy alcalinos Blogsque seguimos Contacto Foro de Discusión Sitiosde interes Vídeosde interés Alimentos ácidos y alcalinos Equilibrio de pH en el cuerpo Si usted tiene algún problema de salud es muy probable que usted sea acídico. Estudios recientes han demostrado que a menos de que el pH del cuerpo este a un nivel un poco alcalino, el cuerpo no se puede curar a si mismo. Por eso no importa la forma que usted use para cuidar sus problemas de salud, no será efectivo a menos que usted incremente el nivel de su pH. Si el pH de su cuerpo no está equilibrado no podrá asimilar vitaminas, minerales y suplementos alimenticios efectivamente. El pH de su cuerpo afecta todo.
- 53. El cuerpo tiene que tener un pH equilibrado en la mayoría de los organismos vivientes en la tierra o no funcionan correctamente. El nivel alcalino es muy importante porque estudios han demostrado que las enfermedades no pueden sobrevivir en un estado alcalino pero en cambio se fortalecen en ambientes acídicos. Si el pH es acídico: la habilidad de absorber nutrientes y minerales disminuirá, la producción de energía en las células disminuirá, la habilidad de curar las células enfermas disminuye, la habilidad de destoxificar metales pesados disminuye, las células de tumores se fortalecen, y el cuerpo se hace más susceptible a la fatiga y las enfermedades. Un pH acídico puede ocurrir por una dieta acídica, estrés emocional, intoxicación, o reacciones inmunológicas que depraven a las células de oxígeno y otros nutrientes. El cuerpo tratara de compensar este pH acídico usando minerales alcalinos.Si la dieta no contiene suficientes minerales para compensar, el ácido se acumulara en las células. El pH se mide en una escala de 0 a 14. Un pH exactamente de 7,0 se dice que es neutro, un pH por debajo de 7,0 es ácido y un pH por encima de 7,0 se dice que es alcalino. Ácidos. ¿Qué son los alimentos ácidos? La noción de ácido que proviene del latín “acidus” se refiere a aquello con sabor de agraz o de vinagre. Un ácido, es una sustancia que, en disolución, incrementa la concentración de iones de hidrógeno. En combinación con las bases, un ácido permite formar sales. ¿Cuáles son las ventajas de consumir alimentos ácidos? Un aspecto a tener presente es que el ácido que componen los alimentos son alimentos importantes. Proporcionan:
- 54. -vitaminas -minerales -proteínas -grasas -fibra Una dieta no está completa sin ellos. Sin embargo, si este ácido que compone los alimentos es mayor que el 20% de la dieta (y en la mayoría de los norteamericanos compone casi el 90% de la dieta) entonces mientras más envejecemos, el cuerpo llega a ser menos eficiente, las células del cuerpo llegan a ser más y más ácidas. El aumento de la acidez de su cuerpo va a resultar en una menor absorción de minerales por el sistema -Disminución de la capacidad para reparar cualquier daño de las células, -El aumento de la fatiga y la enfermedad, y un resultado incluso en enfermedades como el tumor y el estado de coma. Síntomas de un exceso de acidez son: Sabor agrioo viscosoenla boca al levantarse. Ansiasde cítricos o café enel desayuno(conefectoalcalinizante,paracalmarel anteriorsíntoma). Desmineralizaciónque creaproblemasnerviososyemocionales. Uñas quebradizas. Debilitamientogeneral. Por lo tanto, pH ácido del cuerpo es muy peligroso y se debe evitar tanto como sea posible mediante la adopción de una dieta adecuada y mantenerse feliz. ¿Cuáles son las consecuencias de consumir alimentos ácidos?
- 55. Ejemplos de alimentos ácidos VERDURAS ACIDIFICANTES Maíz Lentejas Aceitunas Calabazade invierno FRUTAS ACIDIFICANTES Arándanos Frutas enConservaoglaseado Arándanosagrios Pasas Ciruelas GRANOS ACIDIFICANTES: Amaranto Cebada,Salvadode avena Salvadode trigo,Panes Maíz, Maicena Galletas,Harinade trigo Harina blanca, Centeno Espaguetis,Escanda,Germende Trigo,Trigo GRANOS Y LEGUMBRES ACIDIFICANTES Leche de almendras,FrijolesNegros Garbanzos,Guisantes Frijoles,Lentejas FrijolesPintos,Frijolesrojos Alcalinos: ¿Qué son los alimentos alcalinos? Son alimentos que se basan en conseguir que el pH de la sangre tenga un nivel de alcalinidad de 7,4 para lograr que las reacciones químicas del organismo se produzcan de forma óptima y conseguir así un peso ideal o evitar el envejecimiento celular. Las frutas y las verduras son los pilares básicos de la alcalinidad. La dieta alcalina
- 56. ¿En qué consiste la dieta? Para mantener la salud, la dieta debe consistir en 60% los alimentos alcalinos y 40% de alimentos ácidos. Pero para restaurar la salud la dieta debe ser una verdadera dieta alcalina y debe consistir en 80% los alimentos alcalinos y el 20% de alimentos ácidos. Medicina alternativa Los practicantes de la medicina alternativa promueven un régimen dietario al que también nombran “dieta alcalina” y que es utilizado en el tratamiento de varias condiciones médicas incluyendo cáncer. Se propuso en respuesta para incrementar los niveles de energía, perder peso, tratar cáncer y enfermedades cardíacas, aunque no existan evidencias científicas sobre su buen funcionamiento. En esta versión de dieta alcalina se incluyen aspectos (acerca de) como evitar el consumo de carnes y otras proteínas, comidas procesadas, azúcar refinada, harina blanca y cafeína o realizar ejercicios específicos. Posibles desventajas Debido a que la dieta alcalina promueve la exclusión de ciertos grupos alimenticios, puede ocasionar una dieta poco balanceada que resulte en deficiencia de nutrientes como ácidos grasos, fitonutrientes, así como proteínas y calcio. Se ha recomendado que los pacientes con antecedentes de desórdenes en tejidos u otras condiciones médicas, que requieran monitoreo físico frecuente como diabetes mellitus severa, no utilicen esta dieta sin
- 57. supervisión médica porque corren el riesgo de tener una concentración baja de azúcar en sangre (hipoglucemia) con este tipo de dieta. Pueden existir desmayos. Beneficios de consumir alimentos alcalinos Hacen frente a muchas dolencias y enfermedades. Llevar una dieta alcalina ayuda a disminuir el riesgo de padecer ciertas enfermedades, por ejemplo: Cálculos renales: porque se incrementa el pH urinario, eliminando a través de la orina las toxinas. Retrasan la pérdida ósea, ayudando en el crecimiento y preservación de los huesos a cualquier edad. ¿Cuáles son las consecuencias de consumir alimentos alcalinos? Ejemplos de alimentos alcalinos
- 58. Conocer los alimentos alcalinos brinda la posibilidad de acceder a sus enormes ventajas. Productos como el limón, aguacate, verduras crucíferas como el brócoli o el coliflor, algas, semillas de calabaza, sal marina, soja, col rizada o crespa y el ajo son los más recomendados a la hora de comer. Aunque no solo estas son los alcalinos, tambien podemos mencionar la clasificacion de frutas y verduras. Verduras alcalinas *Alfalfa * La hierbade cebada *Hojas de remolacha*Brócoli *Col *Zanahoria *Coliflor *Apio*Pepino *Dientesde león*Berenjena *Verdurasfermentadas*Ajo *Col rizada*Lechuga *Hongos *Hojasde Mostaza *Cebollas*Chícharos *Pimientas*Calabaza *Rábano *Nabosueco *Espinacas*Brotes *Tomates*Berro *Hierbadel trigo *Hojas VerdesSilvestrescomolaOrtiga *Diente de león Frutas alcalinas *Manzana *Albaricoque *Aguacate *Plátano(altoíndice glucémico) *Bayas *frutas rojasdel bosque tipoBerries *Cerezasácidas* Coco fresco *Uvas Pasas * Uvas *Pomelo*Melon *Limón*Cal *Melones*Nectarina *Naranja *Melocotón *Pera *Piña * Pasas *Frambuesas*Ruibarbo *Fresas*Mandarina *Tomate *Frutas Tropicales *Las ciruelas*Sandía *Pomelo*Lima
- 59. Bien, una vez conocidos algunos de los conceptos iniciales podemos pasar al siguiente paso: La formación de moléculas. Antes que nada, es necesario conocer la posición que ocupan los electrones en el átomo. PUn derivado del petróleo es un producto procesado en refinerías usando como materia prima el petróleo. Según la composición del crudo y la demanda, las refinerías pueden producir distintos productos derivados del petróleo. La mayor parte del crudo es usado como materia prima para obtener energía, por ejemplo la gasolina. También producen sustancias químicas, que se puede utilizar en procesos químicos para producir plástico y/o otros materiales útiles. Debido a que el petróleo contiene un 2% de azufre, también se obtiene grandes cantidades de éste. Hidrógeno y carbón en forma de coque de petróleo pueden ser producidos también como derivados del petróleo. El hidrógeno producido es normalmente usado como producto intermedio para otros procesos como el hidrocracking o la hidrodesulfuración. Los siguientes, son los derivados más comunes que suelen ser obtenidos en las torres de destilación. Todos ordenados desde el compuesto más pesado al más ligero: Residuos sólidos: Aceites y lubricantes, Gasóleo y fueloil, Queroseno,Disolventes, GLP (Gases licuados del petróleo) Refinación del Petróleo
- 60. Una refinería es un enorme complejo donde ese petróleo crudo se somete en primer lugar a un proceso de destilación o separación física y luego a procesos químicos que permiten extraerle buena parte de la gran variedad de componentes que contiene. En términos sencillos, el funcionamiento de una refinería de este tipo se cumple de la siguiente manera: El primer paso de la refinación del petróleo crudo se cumple en las torres de "destilación primaria" o "destilación atmosférica". En su interior, estas torres operan a una presión cercana a la atmosférica y están divididas en numerosos compartimientos a los que se denominan "bandejas" o "platos". Cada bandeja tiene una temperatura diferente y cumple la función de fraccionar los componentes del petróleo. El crudo llega a estas torres después de pasar por un horno, donde se "cocina" a temperaturas de hasta 400 grados centígrados que lo convierten en vapor. El principal producto que sale de la refinación del petróleo es la gasolina motor. El volumen de gasolina que cada refinería obtiene es el resultado del esquema que utilice. En promedio, por cada barril de petróleo que entra a una refinería se obtiene 40 y 50 por ciento de gasolina. El gas natural rico en gases petroquímicos también se puede procesar en las refinerías para obtener diversos productos de uso en la industria petroquímica La Destilación Es La Operación Fundamental Para El Refino Del Petróleo. Su Objetivo Es Conseguir, Mediante Calor, Separar Los Diversos Componentes Del Crudo. Cuando El Crudo Llega A La Refinería Es Sometido A Un Proceso Denominado “Destilación Fraccionada”. El Petróleo Crudo Calentado Se Separa Físicamente En Distintas Fracciones De Destilación Directa, Diferenciadas Por Puntos De Ebullición Específicos Y Clasificadas, Por Orden Decreciente De Volatilidad, En Gases, Destilados Ligeros, Destilados Intermedios, Existen Varios Sistemas De Destilación:
- 61. Destilación Atmosférica:El Crudo Desalinizado Se Precalienta Utilizando Calor Recuperado Del Proceso. Después Pasa A Un Calentador De Carga De Crudo De Caldeo Directo, Y Desde Allí A La Columna De Destilación Vertical, Justo Por Encima Del Fondo, A Presiones Ligeramente Superiores A La Atmosférica. Destilación al vacio :Las torres de destilación al vacío proporcionan la presión reducida necesaria para evitar el craqueo térmico al destilar el residuo, o crudo reducido, que llega de la torre atmosférica a mayores temperaturas. Los diseños internos de algunas torres de vacío se diferencian de los de las torres atmosféricas en que en lugar de platos se utiliza relleno al azar y pastillas separadoras de partículas aéreas. A veces se emplean también torres de mayor diámetro para reducir las velocidades. PETROLEO EN EL MEDIO AMBIENTE El petróleo tiene el problema de ser insoluble en agua y por lo tanto, difícil de limpiar. Además, la combustión de sus derivados produce productos residuales: partículas, CO2, SOx (óxidos de azufre), NOx (óxidos nitrosos), etc. La contaminación por petróleo se produce por su liberación accidental o intencionada en el ambiente, provocando efectos adversos sobre el hombre o sobre el medio, directa o indirectamente. Efectos sobre el suelo: las zonas ocupadas por pozos, baterías, playas de maniobra, piletas de purga, conductos y red caminera comprometen una gran superficie del terreno que resulta degradada.
- 62. Esto se debe al desmalezado y alisado del terreno y al desplazamiento y operación de equipos pesados. Por otro lado los derrames de petróleo y los desechos producen una alteración del sustrato original en que se implantan las especies vegetales dejando suelos inutilizables durante años. Efectos sobre el agua: en las aguas superficiales el vertido de petróleo u otros desechos produce disminución del contenido de oxígeno, aporte de sólidos y de sustancias orgánicas e inorgánicas. En el caso de las aguas subterráneas, el mayor deterioro se manifiesta en un aumento de la salinidad, por contaminación de las napas con el agua de producción de petróleo de alto contenido salino. Efectos sobre el aire: por lo general, conjuntamente con el petróleo producido se e ncuentra gas natural. La captación del gas está determinada por la relación gas/petróleo, si este valor es alto, el gas es captado y si es bajo, es venteado y/o quemado por medio de antorchas. El gas natural está formado por hidrocarburos livianos y puede contener dióxido de carbono, monóxido de carbono y ácido sulfhídrico. Si el gas producido contiene estos gases, se quema. Si el gas producido es dióxido de carbono, se lo ventea. Efectos sobre la flora y la fauna: la fijación de las pasturas depende de la presencia de arbustos y matorrales, que son los más afectados por la contaminación con hidrocarburos. A su vez estos matorrales proveen refugio y alimento a la fauna adaptada a ese ambiente. Dentro de la fauna, las aves son las más afectadas, por contacto directo con los cuerpos de agua o vegetación contaminada, o por envenenamiento por ingestión. El efecto sobre las aves puede ser letal. Si la zona de explotación es costera o mar adentro el derrame de hidrocarburos produce daños irreversibles sobre la fauna marina. PETROLEO Y GASOLINA En el año de 1859 cuando el coronel Edwin Drake extrajo petróleo en Pennsylvania, la fecha que marca la entrada de este importante recurso en la era industrial. Alrededor de 1830 hasta 1850, fueron descubiertas las propiedades del aceite de ballena, La búsqueda de un combustible mejor para las lámparas llevó a una gran demanda de `aceite de piedra' o petróleo, y a mediados del siglo XIX varios científicos desarrollaron procesos para su uso comercial. George Diesel, en 1850, fue uno de ellos y lo vendía como elixir medicinal. Diesel envía dicha sustancia a un grupo de estudiosos, y luego este aceite es destilado y convertido en kerosene. Más tarde, se encuentra petróleo sobre la tierra en mayor cantidad, por lo que se produce kerosene a grandes cantidades.
- 63. Para 1860, ya existían 15 refinerías de kerosene, siendo éste fuente principal de energía para América Latina y Europa. A medida que el mercado de la gasolina crecía, se necesitaban nuevos campos petroleros, los que fueron encontrados en California, formando la UNION OIL COMPANY. Pero este no bastaba para satisfacer la gran demanda, que se pronosticaba para el futuro, por lo que se necesitaba una gran fuente de petróleo. Pattillo Higgins, visionario estadounidense, pensaba que podría encontrar el preciado “oro negro” bajo la capa rocosa de la Tierra. En 1911, en el pueblo de Spilbenton, se dio un gran aprovechamiento del petróleo y aumentando el octanaje de la gasolina, gracias al aporte de Higgins. Se llegó a obtener hasta 100 000 barriles/día. En 1914, se iniciaba la 1º Guerra Mundial, en la que EE.UU. incursionaba 3 años después. Por este motivo, se inventaron nuevas máquinas de guerra, como los tanques de guerra (1915) y los aviones (vehículos a gasolina). Con el descubrimiento del avión, se podía obtener una visión más amplia del terreno, muy útil para los geólogos. Otra invención muy útil fue el sismógrafo, con el que se medían ondas por debajo de la tierra, ayudando a detectar lo subterráneo. Al estallar la 2º Guerra Mundial (1940-1941), EE.UU. contaba con una gran armada basada en petróleo. Para el mejor transporte de éste, fue construido el GRAN OLEODUCTO DE LA GRAN PULGADA. En 1942, Alemania ataca tanques estadounidenses con la ayuda de sus submarinos; por lo que se construye un oleoducto de 1320km de largo al norte de EE.UU. (Houston-Illinois-Filadelfia-New York). Las áreas costeras de California también fueron exploradas, hallando petróleo en ellas. De este descubrimiento surgió la idea de encontrar el crudo mar adentro. Robert Karn y su socio, perforaron muelles mar adentro en el año 1890. Mas en esa época no había maquinaria para los trabajos en el mar. Debido a este inconveniente, Robert y Hill improvisaron tecnología, utilizando también barcos de la marina. A 17km de Louisiana, en el golfo de México el crudo fue descubierto. La excavación en el océano era 5 veces más costosa que en tierra.
- 64. En 1947, se construye la plataforma más grande del mundo, 240km al suroeste de New Orleáns, con un área de 11 583m2. Se hicieron 60 pozos a 1550m por debajo del mar. LA GASOLINA Luego del descubrimiento del petróleo, se comenzó a vislumbrar para qué podría servir una de sus fracciones más ligeras, que es la gasolina. Al descubrir el motor de combustión interna, empezó el boom del automóvil, creando así un enorme mercado para la gasolina, que era utilizada como combustible. El más famoso modelo fue ideado por Henry Ford. Poco a poco se incrementaron las refinerías, obteniendo la gasolina en cantidades enormes, siendo conocida mundialmente, pues era necesaria para el uso de vehículos. y salió en vigencia la LEY DEL AIRE LIMPIO, que exigía gasolina de combustión limpia. Con los catalizadores de calor, se retira el plomo de la gasolina, obteniendo una gasolina purificada y menos contaminante. Debido a la gran contaminación por CO2 se trata de seguir un enfoque a reducir las emisiones, aumentándole etanol. Actualmente, hay un nuevo rumbo de la gasolina (bio diesel), que consiste en extraer combustible natural de la grasa animal y de las semillas de soya. También para reducir la contaminación se desea comenzar la economía del hidrógeno, lo que ayudaría a disminuir considerablemente las emisiones.
- 65. Combustible: Combustible es cualquier material capaz de liberar energía cuando se oxida de forma violenta con desprendimiento de calor poco a poco. Supone la liberación de una energía de su forma potencial (energía de enlace) a una forma utilizable sea directamente (energía térmica) o energía mecánica (motores térmicos) dejando como residuo calor (energía térmica), dióxido de carbono y algún otro compuesto quimico. En general se trata de sustancias susceptibles de quemarse, pero hay excepciones que se explican a continuación. Hay varios tipos de combustibles: Entre los combustibles sólidos se incluyen el carbón, la madera y la turba. El carbón se quema en calderas para calentar agua que puede vaporizarse para mover máquinas a vapor o directamente para producir calor utilizable en usos térmicos (calefacción). La turba y la madera se utilizan principalmente para la calefacción doméstica e industrial, aunque la turba se ha utilizado para la generación de energía y las locomotoras que utilizaban madera como combustible eran comunes en el pasado. Entre los combustibles fluidos, se encuentran los líquidos como el gasóleo, el queroseno o la gasolina (o nafta) y los gaseosos, como el gas natural o los gases licuados de petróleo (GLP), representados por el propano y el butano. Las gasolinas, gasóleos y hasta los gases, se utilizan para motores de combustión interna.El combustible se utiliza en autos lo que contamina grandes ciudades y tambien el medio ambiente En los cuerpos de los animales, el combustible principal está constituido por carbohidratos, lípidos, proteínas, que proporcionan energía para el movimiento de los músculos, el crecimiento y los procesos de renovación y regeneración celular, mediante una combustión lenta, dejando también, como residuo, energía térmica, que sirve para mantener el cuerpo a la temperatura adecuada para que funcionen los procesos vitales. Se llaman también combustibles a las sustancias empleadas para producir la reacción nuclear en el proceso de fisión, aunque este proceso no es propiamente una combustión. Tampoco es propiamente un combustible el hidrógeno, cuando se utiliza para proporcionar energía (y en grandes cantidades) en el proceso de fusión nuclear, en el que se funden atómicamente dos átomos de hidrógeno para convertirse en uno de helio, con gran liberación de energía. Este medio de obtener energía no ha sido dominado en su totalidad por el hombre (salvo en su forma más violenta: la bomba nuclear de hidrógeno, conocida también como Bomba H) pero en el universo es común, específicamente como fuente de energía de las estrellas
- 66. Los hidrocarburos Son compuestos químicos orgánicos que se encuentran constituidos en exclusiva por carbono e hidrógeno. Según la naturaleza de sus enlaces se pueden clasificar en: Hidrocarburos de cadena abierta o cerrada. Dentro de los hidrocarburos de cadena abierta encontramos: - Hidrocarburos saturados → Alcanos, hidrocarburos que carecen de enlaces dobles o triples. Son moléculas unidas mediante enlaces de tipo simple. - Hidrocarburos insaturados → Alquenos, moléculas formadas por átomos que se unen entre sí mediante enlaces de tipo doble, y alquinos, moléculas cuyos enlaces son de tipo triple. Dentro de los hidrocarburos de cadena cerrada encontramos: Hidrocarburos alicíclicos, que a su vez se subdividen en saturados o también conocidos como cicloalcanos e insaturados. Estos últimos se subdividen en cicloalquenos y cicloalquinos. -Cicloalcanos: también llamados alcanos cíclicos, poseen un esqueleto de carbono formado en exclusiva por átomos de carbono que se unen entre sí mediante enlaces de tipo simple formando un anillo. Siguen la fórmula general: CnH2n. Este tipo de hidrocarburos se nomina igual que los alcanos pero añadiendo el prefijo ciclo- delante del nombre. -Cicloalquenos: Son hidrocarburos que en su estructura tienen como mínimo un enlace de tipo doble covalente. Este tipo de enlaces posee cierta capacidad elástica si los comparamos con los de otras moléculas, elasticidad que se hace mayor cuando mayor sea la molécula. -Cicloalquinos: Son hidrocarburos cíclicos que tienen presente en su estructura enlaces de tipo triple. Generalmente son moléculas estables solamente si poseen un anillo suficientemente grande, siendo el ciclooctino, con ocho carbonos, el cicloalquino más pequeño. Hidrocarburos aromáticos: También conocidos como bencénicos, son moléculas que poseen al menos un anillo aromático dentro de su estructura.
- 67. Todos los hidrocarburos, excepto los aromáticos, reciben también el nombre de hidrocarburos alifáticos. El término de hidrocarburos saturados o insaturados que se suele añadir a los alcanos o cicloalcanos, hace referencia a la imposibilidad de dichas moléculas para añadir a su estructura más hidrógenos, pues los átomos de carbono no tienen más enlaces en disponibilidad para ellos. En cambio, los alquenos, alquinos, cicloalquenos y cicloalquinos, debido a tener enlaces de tipo múltiple, pueden añadir más átomos de hidrógeno a su estructura molecular a través de reacciones de adición, por lo cual se les denomina también como hidrocarburos insaturados. Los alcanos se subdividen en dos tipos: Lineales: por ejemplo, CH3CH3 (etano), CH3CH2CH3 (propano), CH3CH2CH2CH3 ( butano), etc. Ramificados: Los alcanos ramificados son compuestos formados por la sustitución de átomosde hidrógeno del hidrocarburo, por los llamados grupos alquilo, los cuales se enganchan a la cadena de carbonos. Tanto los alquenos como los alquinos pueden ser, al igual que los alcanos, de tipo lineal o ramificados. Un grupo alquilo, también conocido como radical alquilo, es una agrupación de átomos que proceden de la eliminación del hidrógeno de un alcano, por lo cual, el grupo alquilo contiene un electrón disponible para compartir en la formación de un enlace covalente. Los grupos alquilo se nombran cambiando la terminación –ano, por –ilo o –il, pero se suelen designar con la letra -R ( de radical). ALCANOS ¿Qué son? Son compuestos de C e H (de ahí el nombre de hidrocarburos) de cadena abierta que están unidos entre sí por enlaces sencillos (C-C y C-H). Su fórmula molecular es CnH2n+2, siendo n el nº de carbonos.
- 68. ¿Cómo se nombran? Los cuatro primeros tienen un nombre sistemático que consiste en los prefijos met-, et-, prop-, y but- seguidos del sufijo "-ano". Los demás se nombran mediante los prefijos griegos que indican el número de átomos de carbono y la terminación "-ano Se llama radical alquilo a las agrupaciones de átomos procedentes de la eliminación de un átomo de H en un alcano, por lo que contiene un electrón de valencia disponible para formar un enlace covalente. Se nombran cambiando la terminación -ano por -ilo, o -il cuando forme parte de un hidrocarburo. Cuando aparecen ramificaciones (cadenas laterales) hay que seguir una serie de normas para su correcta nomenclatura. * Se elige la cadena más larga. Si hay dos o más cadenas con igual número de carbonos se escoge la que tenga mayor número de ramificaciones. 3-metil-hexano * Se numeran los átomos de carbono de la cadena principal comenzando por el extremo que tenga más cerca alguna ramificación, buscando que la posible serie de números "localizadores" sea siempre la menor posible. 2,2,4-trimetil-pentano, y no 2,4,4-trimetil-pentano * Las cadenas laterales se nombran antes que la cadena principal, precedidas de su correspondiente número localizador y con la terminación "-il" para indicar que son radicales. * Si un mismo átomo de carbono tiene dos radicales se pone el número localizador delante de cada radical y se ordenan por orden alfabético. 4-etil-2-metil-5-propil-octano
- 69. * Si un mismo radical se repite en varios carbonos, se separan los números localizadores de cada radical por comas y se antepone al radical el prefijo "di-", "tri-", "tetra-", etc 2,3-dimetil-butano * Si hay dos o más radicales diferentes en distintos carbonos, se nombran por orden alfabético anteponiendo su número localizador a cada radical. en el orden alfabético no se tienen en cuenta los prefijos: di-, tri-, tetra- etc. así como sec-, terc-, y otros como cis-, trans-, o-, m-, y p-; pero cuidado si se tiene en cuenta iso- 5-isopropil-3-metil-octano * Por último, si las cadenas laterales son complejas, se nombran de forma independiente y se colocan, encerradas dentro de un paréntesis como los demás radicales por orden alfabético. En estos casos se ordenan por la primera letra del radical. Por ejemplo, en el (1,2-dimetilpropil) si tendremos en cuenta la "d" para el orden alfabético, por ser un radical complejo 5-(1,2-dimetilpropil)-4-etil-2-metil-nonano Propiedades físicas Punto de ebullición: bajo condiciones normales, los alcanos desde el CH4 hasta el C4H10son gases; desde el C5H12 hasta C17H36 son líquidos; y los posteriores a C18H38 son sólidos. El punto de ebullición está determinado principalmente por el peso. Se incrementa entre 20 y 30 °C por cada átomo de carbono agregado a la cadena. Un alcano de cadena lineal tendrá un mayor punto de ebullición que un alcano de cadena ramificada, debido a la mayor área de la superficie en contacto, con lo que hay mayores fuerzas de van der Waals, entre moléculas adyacentes. Por otra parte, los cicloalcanos tienden a tener mayores puntos de ebullición que sus contrapartes lineales, debido a las conformaciones fijas de las moléculas, que proporcionan planos para el contacto intermolecular.
- 70. Punto de fusión: sigue una tendencia similar al punto de ebullición. A mayor peso molar, mayor punto. Los alcanos de longitud impar tienen puntos de fusión ligeramente menores, comparados con los alcanos de longitud par. Esto es debido a que los alcanos de longitud par se ordenan bien en la fase sólida, formando una estructura bien organizada, que requiere mayor energía para romperse. Densidad La densidad aumenta con el número de átomos de carbono pero siempre es inferior a la del agua, por lo que flotan en la superficie de la misma. Propiedades Químicas Tienen una baja reactividad por cuanto sus enlaces son estables, no se rompen con facilidad. Reaccionan con los halógenos y con el oxígeno en una combustión sin humo. Usos Los cuatro primeros alcanos son usados principalmente para propósitos de calefacción y cocina. El metano y el etano son los principales componentes del gas natural El propano y el butano pueden ser líquidos a presiones moderadamente bajas y son conocidos como gases licuados. Estos dos alcanos son usados también como propelentes en pulverizadores. Desde el pentano hasta el octano los alcanos son líquidos razonablemente volátiles. Se usan como combustibles en motores de combustión interna. Además de su uso como combustibles, los alcanos medios son buenos solventes para las sustancias no polares. Los hidrocarburos de 9 a 16 átomos de carbono son líquidos de alta viscosidad y forman parte del diesel y combustible de aviones. Los alcanos a partir del hexadecano en adelante constituyen los componentes más importantes de los aceites lubricantes. Los alcanos con una longitud de cadena de aproximadamente 35 o más átomos de carbono se encuentran en el betún y tienen poco valor. CICLO ALQUENOS Son hidrocarburos alicíclicos, donde existe enlace doble entre átomos de carbono. Nomenclatura: a) Se nombran como a los alquenos de igual número de átomos de carbono, solo que anteponiendo la palabra "Ciclo". b) Cuando hay varios enlaces dobles, se busca el sentido de numeración, tal que los carbonos con doble enlace tengan los números más bajos, usando la terminación dieno, trieno, etc. c) Si hay sustituyentes, el sentido de numeración es aquel donde los números más bajos corresponden a los carbonos con doble enlacve. Si ello es indiferente, se optará por números más bajos para los carbonos con sustituyentes.
- 71. Ejemplos.