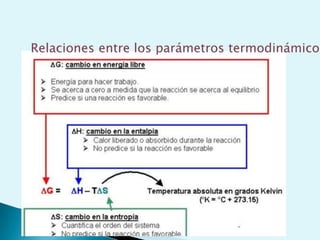
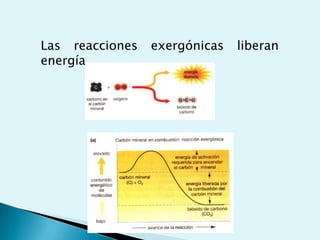
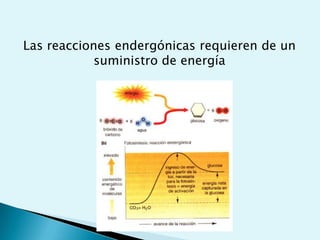
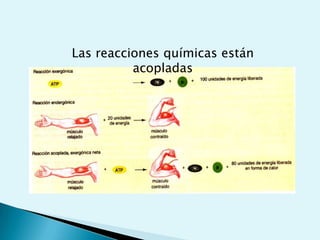
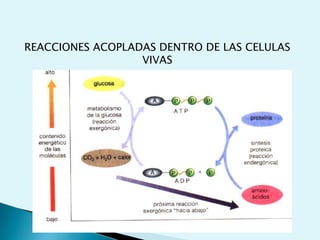
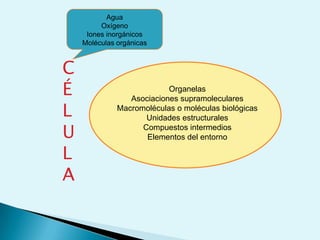
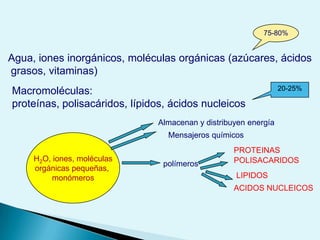
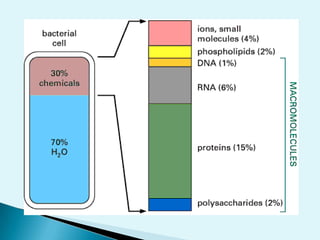
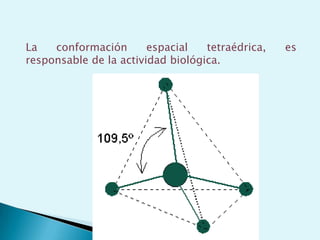
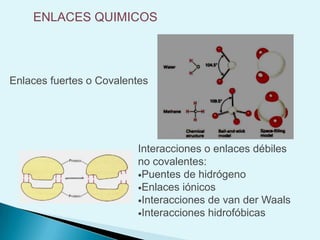
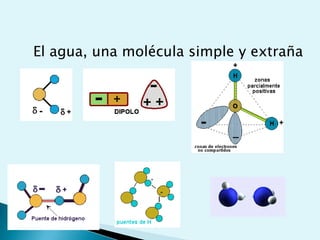
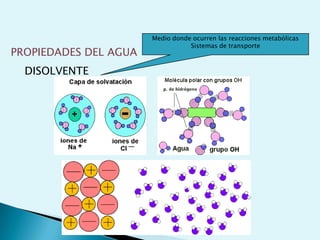
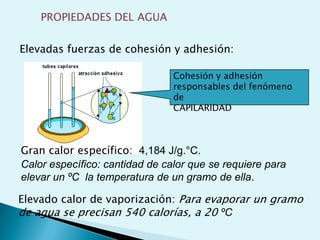
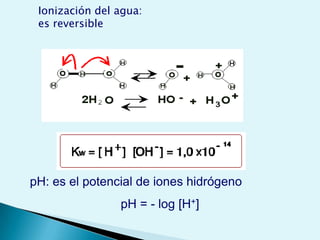
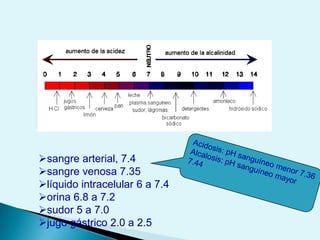
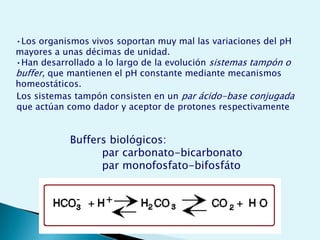
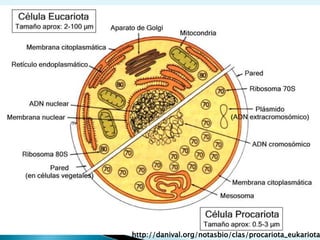
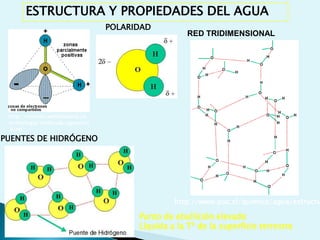
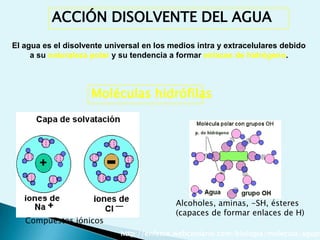
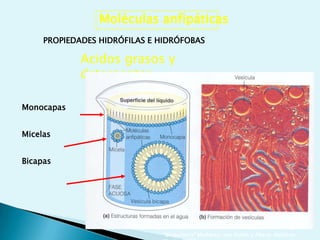
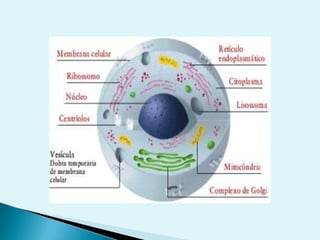
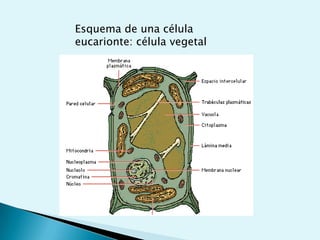
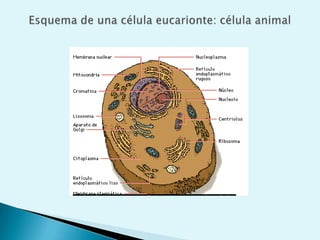
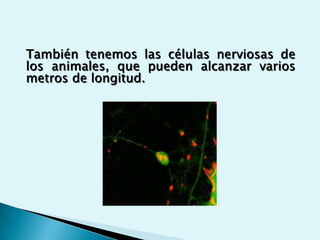
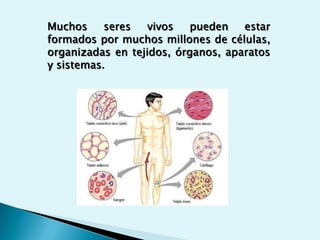
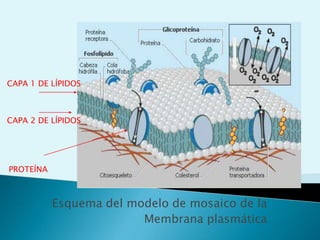
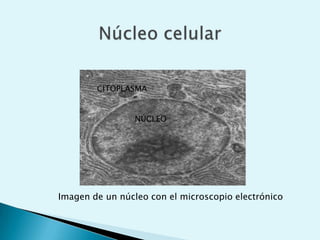
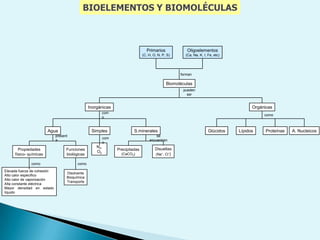
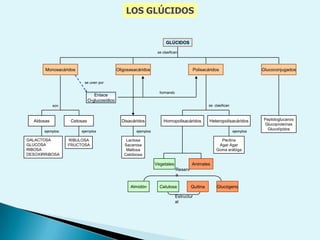
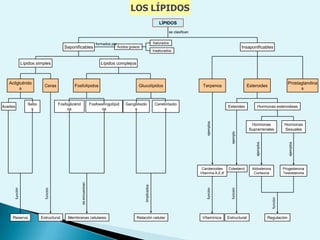
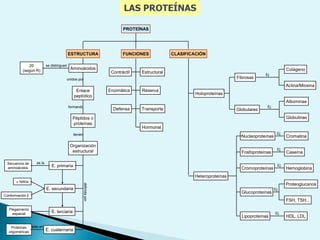
El documento proporciona una introducción a la bioquímica como ciencia. Explica que estudia los componentes químicos y biomoléculas de los seres vivos, así como sus propiedades y funciones. Describe las características de la materia viva como su complejidad, orden y capacidad de replicación. Además, resume la estructura y organización celular de procariotas y eucariotas.


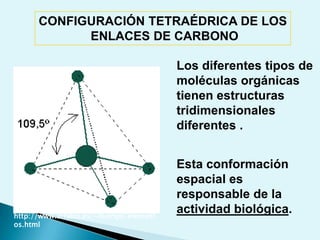



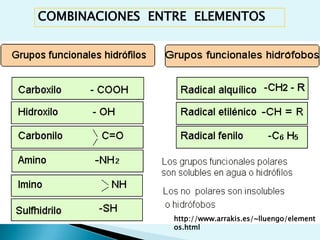

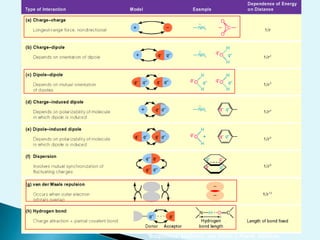
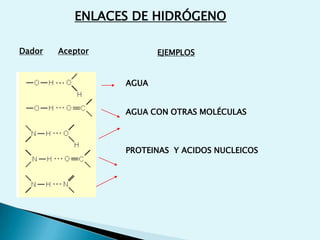








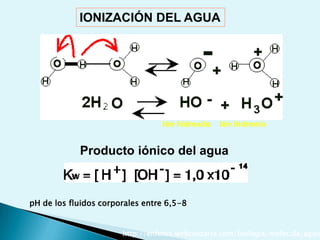











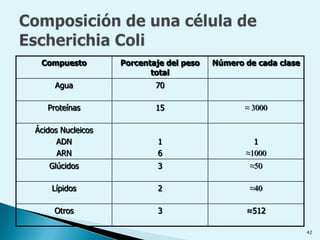
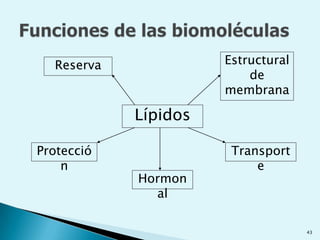
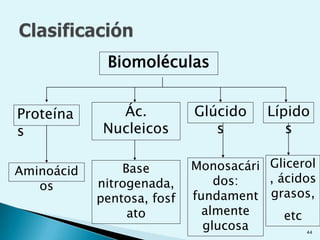
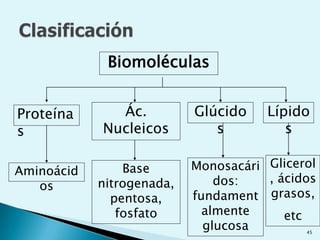

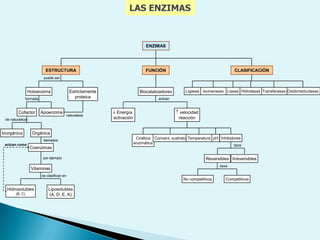
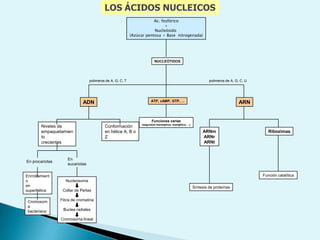

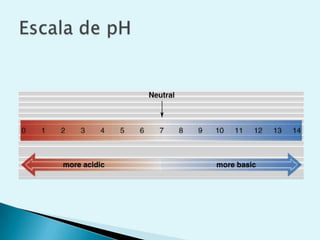






![Escala de pHEs la forma de medir el grado de acidez de una disolución. pH = - log [ H + ]Existen varios procesos bioquímicos, se encuentran determinados por el pH como el transporte de oxígeno en la sangre.Las soluciones básicas tienen valores de pH mayores de 7.0 las soluciones ácidas tienen valores de pH menores de 7.0 .](https://image.slidesharecdn.com/bioquimica1eraclase-100209145037-phpapp01/85/Bioquimica-1era-Clase-61-320.jpg)