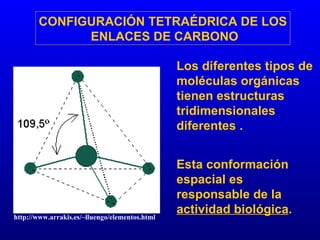
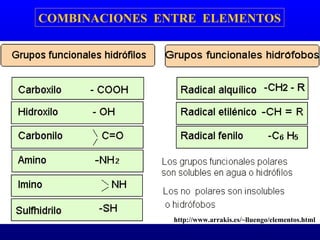
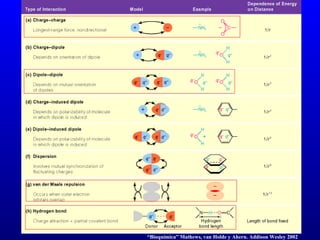
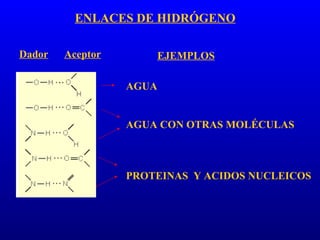
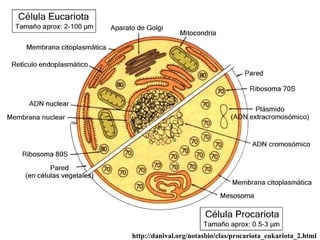
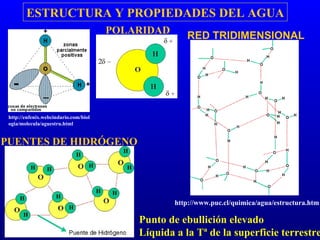
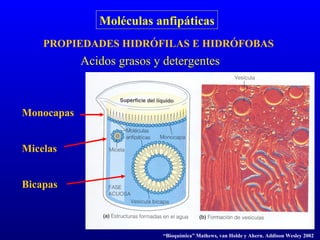
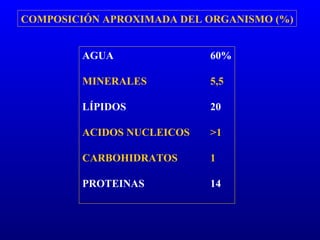
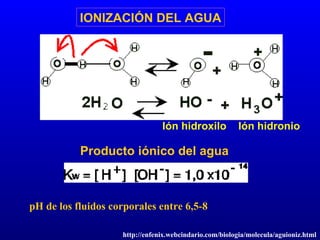
El documento describe los componentes básicos de la materia viva, incluyendo bioelementos como carbono, hidrógeno y oxígeno, así como biomoléculas como proteínas, lípidos y ácidos nucleicos. Explica que las células, ya sean procariotas u eucariotas, están constituidas por los mismos elementos químicos y moléculas, reflejando su origen evolutivo común. Además, destaca que el agua es esencial para los procesos biológicos al proporcionar un