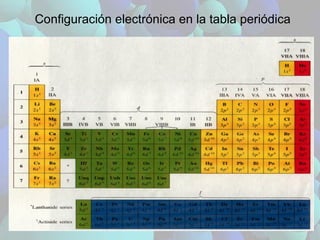
La configuración electrónica de los elementos es periódica y determina sus propiedades físicas y químicas. Elementos con configuraciones similares se agrupan en la tabla periódica. El radio atómico disminuye dentro de cada período debido al aumento de la carga nuclear efectiva e incrementa dentro de cada grupo debido al tamaño creciente de los orbitales. La energía de ionización aumenta al moverse de izquierda a derecha dentro de un período y disminuye al bajar dentro de un grupo.