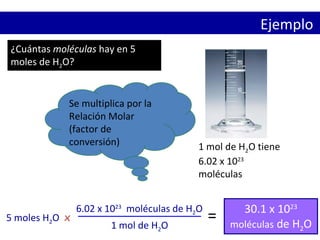
El documento explica el concepto de mol y las diferentes formas de definirlo y relacionarlo con la cantidad de sustancia, la masa y el número de partículas. Se define el mol como la cantidad de sustancia que contiene exactamente 6.022x10^23 unidades elementales como átomos, moléculas o fórmulas unitarias. También se explica cómo calcular la masa molar, las relaciones entre moles, masa y número de partículas usando la constante de Avogadro.