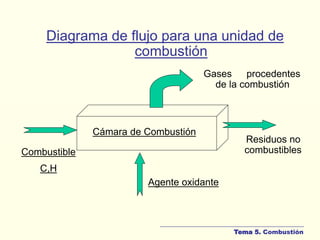
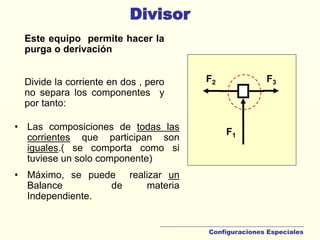
Este documento presenta los temas y clases de un curso sobre balances de materia y energía. El tema 1 trata sobre balances de masa, incluyendo preliminares, fundamentos, balances múltiples y aplicaciones computacionales. El tema 2 cubre sistemas monofásicos como gases, vapores, líquidos y sólidos. El tema 3 trata balances de energía. Finalmente, el tema 4 analiza procesos reactivos y el tema 5 se enfoca en la combustión. El documento incluye definiciones clave y ejemplos de balances para diferentes