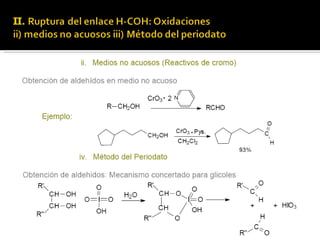
1) Los alcoholes son compuestos orgánicos en los que un átomo de hidrógeno del agua ha sido sustituido por un radical orgánico, excepto en el caso de los fenoles.
2) Los alcoholes pueden clasificarse como primarios, secundarios o terciarios dependiendo de la estructura de carbono al que esté unido el grupo hidroxilo.
3) Los alcoholes reaccionan para formar sales mediante la pérdida de un protón, éteres a través de la formación de la sal y reacción con



![Energía del enlace de puente de hidrógeno : 21 [KJ/mol] Distancia de enlace O·······H : 207 [pm] Energía del enlace covalente O-H : 435 [KJ/mol] Distancia de enlace O-H : 96 [pm]](https://image.slidesharecdn.com/clasesdealcoholes2011-ppt-120108074557-phpapp02/85/Clases-de-alcoholes_2011-ppt-4-320.jpg)







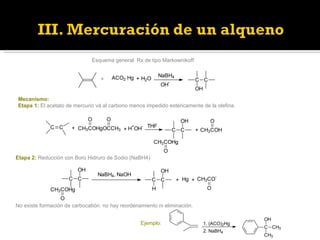

![3.- Hidrólisis en medio básico La reacción solo esta influenciada por impedimentos estéricos. El agente borante 9-borabiciclo [3,3,1] nonato (9-BBN) se utiliza para aumentar la reactividad en el sitio menos impedido. Ejemplo:](https://image.slidesharecdn.com/clasesdealcoholes2011-ppt-120108074557-phpapp02/85/Clases-de-alcoholes_2011-ppt-14-320.jpg)