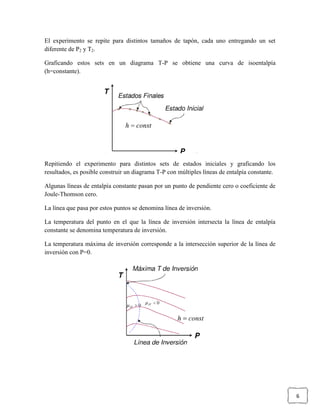
El documento describe el coeficiente de Joule-Thomson y el experimento del tapón poroso. El coeficiente de Joule-Thomson (μ) representa el cambio de temperatura de un gas con el cambio de presión durante una expansión isenthalpica. Para la mayoría de los gases a baja presión, μ es positivo y la temperatura disminuye durante la expansión, mientras que a alta presión o para gases como el helio y el hidrógeno, μ puede ser negativo y la temperatura aumenta. El experimento del tapón poroso mide los cambios