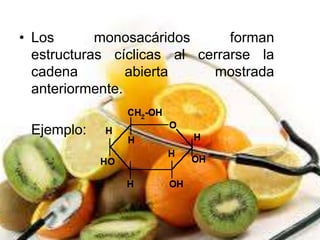
Los compuestos biológicos, o hidratos de carbono, son biomoléculas formadas por carbono, hidrógeno y oxígeno, que son esenciales para proporcionar energía y estructura a los seres vivos. Se clasifican en monosacáridos, disacáridos y polisacáridos, y desempeñan múltiples funciones en el organismo, como energía, reserva y estructura celular. Los monosacáridos más importantes son la glucosa, galactosa y fructosa, cada uno con funciones biológicas específicas y relevancia en la nutrición.