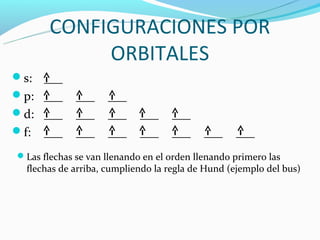
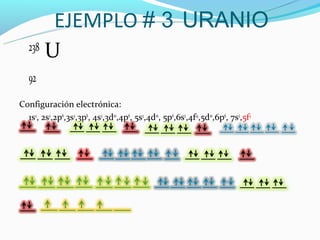
El documento describe el modelo actual del átomo, incluyendo que tiene un núcleo atómico y una nube electrónica. Explica los niveles y subniveles de energía de los electrones, así como las reglas para determinar la configuración electrónica de un átomo, como la regla de Aufbau, la regla de Hund y la regla de diagonales. También muestra ejemplos del cálculo de la configuración electrónica para el calcio, cloro y uranio.
















![CONFIGURACIONES ABREVIADAS
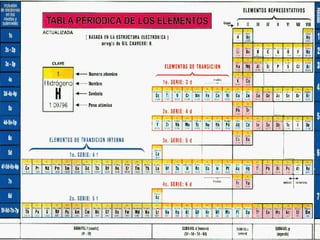
Configuración del 17Cl:
1s2, 2s2,2p6,3s2,3p5
Configuración del 10Ne
1s2, 2s2,2p6
Abreviada: [10Ne] ,3s2,3p5](https://image.slidesharecdn.com/configuracioneselectrnicas-120822210853-phpapp01/85/Configuraciones-electronicas-22-320.jpg)
![CONFIGURACIONES ABREVIADAS
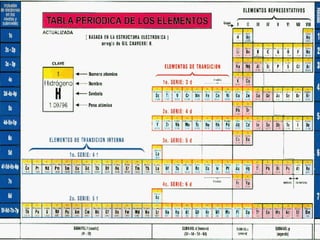
Configuración del 20Ca:
1s2, 2s2,2p6,3s2,3p6, 4s2
Configuración del 18Ar
1s2, 2s2,2p6,3s2,3p6
Abreviada: [18Ar ] 4s2](https://image.slidesharecdn.com/configuracioneselectrnicas-120822210853-phpapp01/85/Configuraciones-electronicas-23-320.jpg)
![CONFIGURACIONES ABREVIADAS
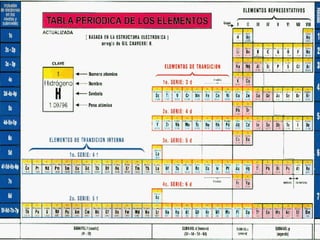
Configuración del 26Fe:
1s2, 2s2,2p6,3s2,3p6, 4s2,3d6
Configuración del 18Ar
1s2, 2s2,2p6,3s2,3p6
Abreviada: [18Ar] 4s2,3d6](https://image.slidesharecdn.com/configuracioneselectrnicas-120822210853-phpapp01/85/Configuraciones-electronicas-24-320.jpg)
![CONFIGURACIONES ABREVIADAS
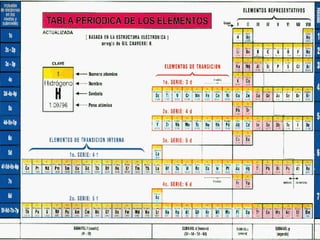
Configuración del 92U:
1s2, 2s2,2p6,3s2,3p6, 4s2,3d10,4p6, 5s2,4d10,
5p6,6s2,4f14,5d10,6p6, 7s2,5f4
Configuración del 86Rn
1s2, 2s2,2p6,3s2,3p6, 4s2,3d10,4p6, 5s2,4d10,
5p6,6s2,4f14,5d10,6p6
Abreviada: [86Rn] 7s2, 5f4](https://image.slidesharecdn.com/configuracioneselectrnicas-120822210853-phpapp01/85/Configuraciones-electronicas-25-320.jpg)