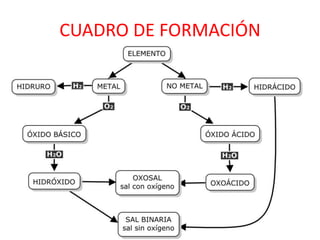
Los compuestos químicos se forman por la combinación de los 92 elementos naturales. Los compuestos se clasifican en inorgánicos u orgánicos, siendo estos últimos aquellos que contienen carbono. Los óxidos son compuestos binarios formados por la combinación de oxígeno con otro elemento, clasificándose en óxidos básicos si el otro elemento es un metal, y óxidos ácidos si es un no metal.