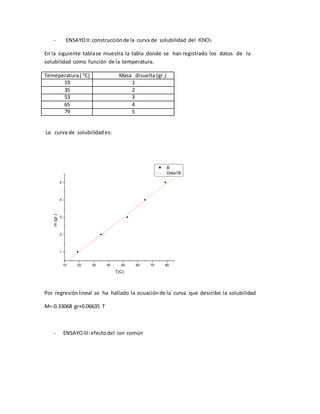
Este documento describe tres experimentos: 1) la preparación de sales poco solubles mediante la formación de precipitados, 2) la construcción de una curva de solubilidad para KNO3 al variar la temperatura, y 3) el efecto del ion común en la solubilidad. La curva de solubilidad de KNO3 resultó ser lineal, indicando que la masa disuelta es directamente proporcional a la temperatura. El ion común afecta la solubilidad al cambiar la concentración de los iones cuando se alcanza un nuevo equilibrio.

![𝐾𝑝𝑠 = [ 𝐶𝑛 +] 𝑚[ 𝐴𝑚 −] 𝑛
El valorde Kps indicalasolubilidadde uncompuestoiónico,esdecir,cuantomenorseasuvalor
menossoluble seráel compuesto.Tambiénesfácilmenteobservableque si aumentamosla
concentraciónde unode los componentesoiones (porejemplo,añadiendounasustanciaque al
disociarse produce ese mismoion)yalcanzamosde nuevoel equilibrio,laconcentracióndel otro
ionse verá disminuida(loque se conoce comoefectoioncomún).
Hay dos formasde expresarlasolubilidadde una sustancia:comosolubilidadmolar,númerode
molesde solutoenunlitrode una disoluciónsaturada(mol/L);ycomosolubilidad,númerode
gramos de solutoenunlitrode unadisoluciónsaturada(g/L).Todoestohade calcularse teniendo
encuenta unatemperaturaque ha de permanecerconstante yque suele serlaindicadaenlas
condicionesestándarode laboratorio(P=101 kPa,T=25ºC).
3 MATERIALES Y REACTIVOS
- Soporte
- Pinzas
- Matraces
- Erlenmeyer
- Pipetas
- Termómetro
- Balanza
- Papel filtro
- Tijeras
- Embudo
- Cu(So)2 H2 O
- NaCl
- AgNO3
- NaBr
- HCl
- Na(OH)
- KI
4. PROCEDIMIENTO EXPERIEMNTAL
ENSAYOI: preparaciónde sales insolubles y formación de precipitados.](https://image.slidesharecdn.com/construcciondecurvasdesolubilidad-160406122556/85/Construccion-de-curvas-de-solubilidad-2-320.jpg)