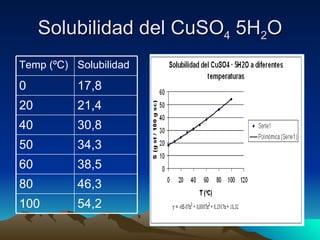
1) La solubilidad se refiere a la cantidad máxima de soluto que puede disolverse en un solvente a una temperatura y presión determinadas.
2) Los factores que afectan la solubilidad incluyen la naturaleza del soluto y el solvente, la temperatura, y la presión (en el caso de solutos gaseosos).
3) La cristalización es una técnica que permite purificar sustancias aprovechando diferencias en su solubilidad al variar la temperatura.
![Solubilidad Material de apoyo, Cuarto Medio [email_address]](https://image.slidesharecdn.com/solubilidad-111205193736-phpapp01/85/Solubilidad-1-320.jpg)