El documento presenta una introducción a la química de la coordinación. Explica conceptos clave como metales de transición, ligandos, geometrías, isomería, teorías de enlace como la teoría del campo cristalino y TOM. También describe factores que afectan el desdoblamiento como la serie del metal, estado de oxidación, geometría y naturaleza del ligando.
![FERNANDO CARRILLO HERMOSILLA [email_address] INTRODUCCIÓN A LA QUÍMICA DE LA COORDINACIÓN ÁREA DE QUÍMICA INORGÁNICA FACULTAD DE CIENCIAS QUÍMICAS DE CIUDAD REAL UNIVERSIDAD DE CASTILLA-LA MANCHA](https://image.slidesharecdn.com/coordinacion-100505074706-phpapp02/85/Coordinacion-1-320.jpg)












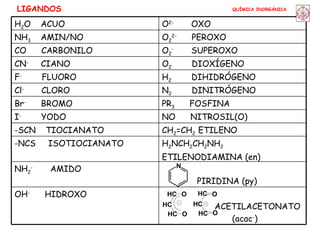


































![QUÍMICA INORGÁNICA EFECTO QUELATO [Cu(OH 2 ) 6 ] 2+ + en [Cu(OH 2 ) 4 (en)] 2+ + 2 H 2 O S o =+23 JK -1 mol -1 [Cu(OH 2 ) 6 ] 2+ + 2NH 3 [Cu(OH 2 ) 4 (NH 3 ) 2 ] 2+ + 2 H 2 O S o =-8.4 JK -1 mol -1 La formación de quelatos estabiliza los complejos. Especialmente favorables los ciclos de 5 y 6 eslabones.](https://image.slidesharecdn.com/coordinacion-100505074706-phpapp02/85/Coordinacion-50-320.jpg)


