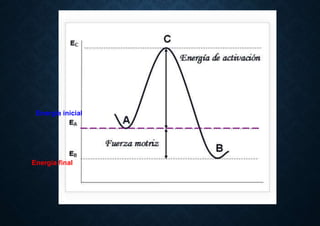
El documento proporciona información sobre el concepto y tipos de corrosión. Define la corrosión como la destrucción de un material causada por un ataque químico o electroquímico que ocurre en la superficie y causa pérdida de masa y deterioro de las propiedades. Explica que la corrosión ocurre por la diferencia de potencial entre dos metales o áreas de un mismo metal en presencia de un electrolito. Describe los tipos principales de corrosión como la generalizada, galvánica, por picadura, fisuras















![RELACIÓN DE LOS DIFERENTES PRODUCTOS
RESULTANTES DE LA OXIDACIÓN DEL HIERRO Y SUS
RESPECTIVOS COLORES:
Fe (III):
- Fe2O3 rojo
- Fe(OH)3 pardo
- (Ac)2Fe(OH) pardo
- Fe4[Fe(CN)6]3 azul
- FePO4 amarillo
Fe (II):
- Fe(OH)2
- FeO Negro
verde
- Fe C O2 2 4
- FeCO3
amarillo
verde
- Fe (CN) Fe blanco2 6
- Fe4[Fe(CN)6]3
- SFe negro
azul](https://image.slidesharecdn.com/corrosion-metales1-150227221205-conversion-gate01/85/Corrosion-17-320.jpg)


































