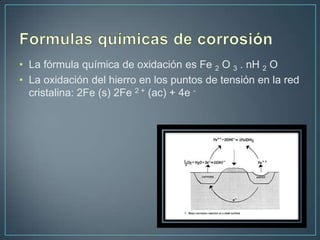
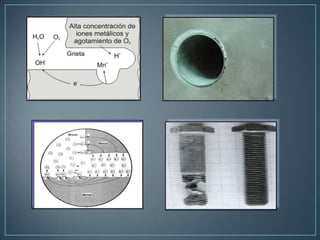
El documento describe los diferentes tipos de corrosión que afectan a los metales, incluyendo la corrosión uniforme, por picaduras, galvánica y en los límites de grano. Explica que la corrosión es la causa principal de la degradación de materiales naturales y fabricados por el hombre, y que representa grandes pérdidas económicas cada año, como la destrucción del 25% de la producción anual de acero.