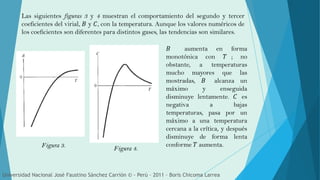
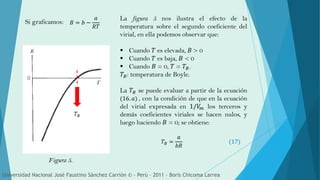
Este documento describe las desviaciones de los gases reales de la ley de los gases ideales. Explica que a altas presiones y bajas temperaturas, especialmente cuando el gas está cerca de licuarse, los gases reales no se comportan como los ideales. Introduce el factor de compresión y la ecuación del virial, que relaciona la presión, volumen y temperatura mediante coeficientes viriales que miden las desviaciones del comportamiento ideal.