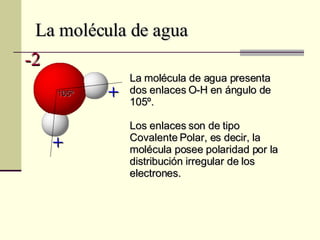
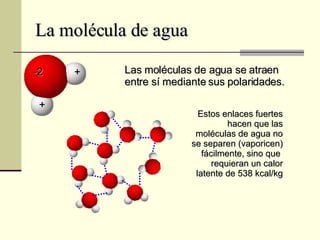
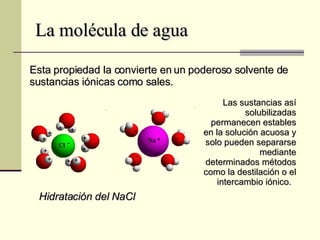
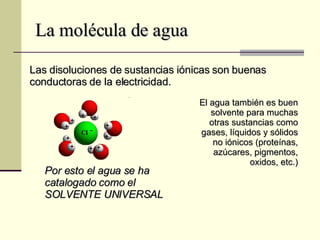
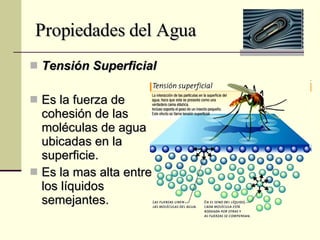
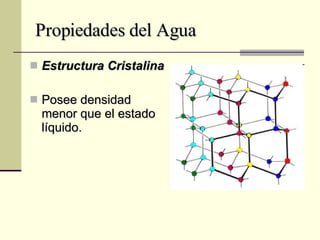
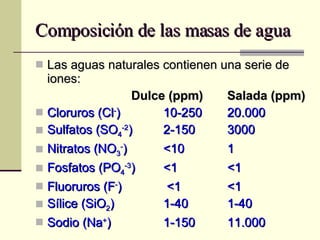
El documento describe las propiedades fundamentales del agua, incluyendo su composición química, polaridad, capacidad de disolución, puntos de ebullición y congelación, y parámetros de calidad como dureza, turbidez, pH y demanda bioquímica y química de oxígeno. También explica conceptos como molalidad, presión osmótica y tensión superficial del agua.