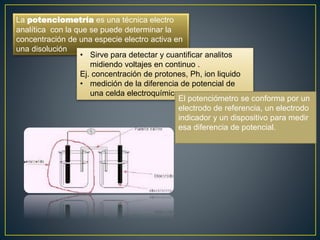
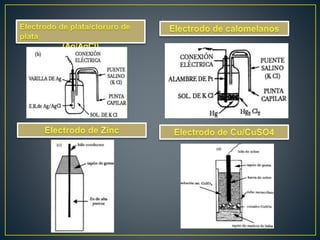
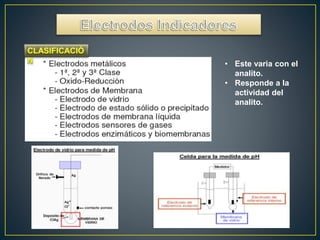
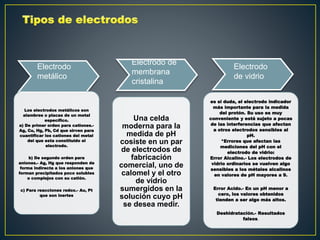
La potenciometría es una técnica electroanalítica que permite determinar la concentración de especies electroactivas midiendo diferencias de potencial eléctrico. Se compone de un electrodo de referencia, un electrodo indicador y un dispositivo de medición. Mide voltajes de forma continua para detectar y cuantificar analitos como protones. La ecuación de Nernst relaciona el potencial eléctrico con la actividad de la especie.