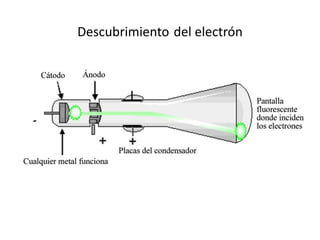
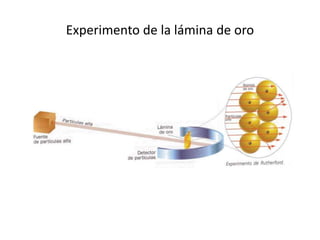
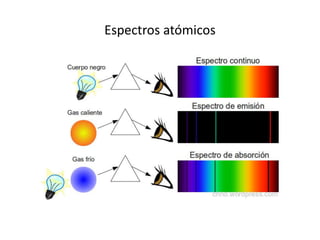
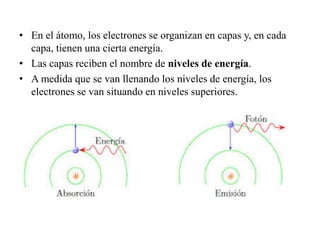
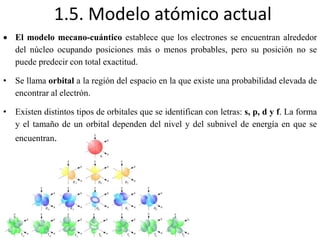
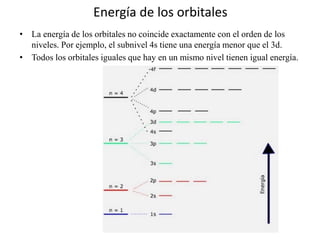
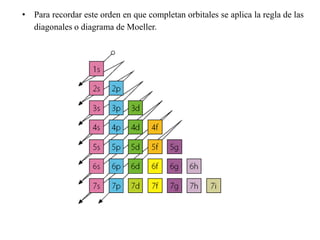
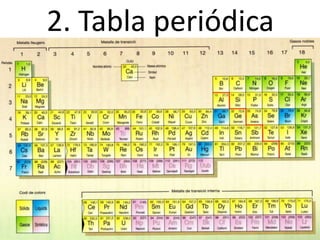
Este documento describe la evolución de los modelos atómicos desde la antigua Grecia hasta el modelo atómico actual. Comienza con los primeros modelos de Demócrito de átomos indivisibles y continúa explicando los modelos posteriores de Dalton, Thomson, Rutherford, Bohr y el modelo mecano-cuántico actual. También introduce la tabla periódica y explica los diferentes tipos de enlaces químicos entre átomos.

![1. Modelos atómicos
Los griegos se planteaban la cuestión de si la materia era continua o discontinua,
es decir, si podía ser dividida y subdividida indefinidamente en un polvo cada vez
más fino, o si, al final de este proceso, se llegaría a un punto en el que las partículas
fueran indivisibles. Leucipo y su discípulo Demócrito insistían- el año 450 a C- que
la segunda hipótesis era la verdadera. Demócrito dió a estas partículas un nombre:
las llamó átomos (es decir “no divisibles”).
A principios del siglo XIX, el químico inglés John Dalton observó los elementos
desde un punto de vista diferente. [...... ]
Introducción a la ciencia, ISAAC ASIMOV](https://image.slidesharecdn.com/elementoscompuestos-150515111332-lva1-app6891/85/Elementos-compuestos-2-320.jpg)