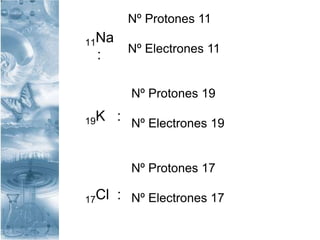
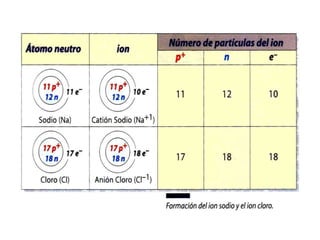
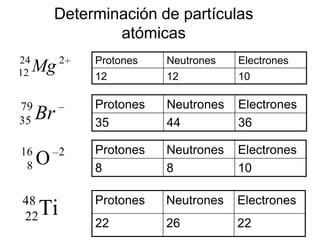
Este documento presenta la información sobre una clase sobre partículas subatómicas. Explica conceptos como número atómico, número másico, átomos neutros, iones y partículas atómicas. También define isótopos, isóbaros e isótonos y presenta ejemplos para ilustrar estos conceptos. El objetivo es que los estudiantes comprendan la estructura atómica y puedan identificar diferentes tipos de átomos.