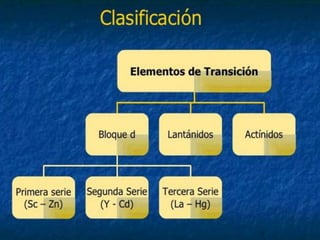
El documento habla sobre los metales de transición. Estos elementos se encuentran en los bloques d y f de la tabla periódica y tienen propiedades como puntos de ebullición y fusión altos, diversos estados de oxidación, y la capacidad de formar iones coloreados. Algunos ejemplos de metales de transición son el hierro, cobre, cromo, y molibdeno.