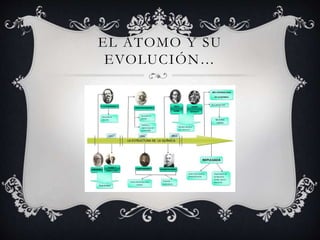
El documento explica cómo los números cuánticos describen la estructura atómica y permiten entender por qué los elementos químicos emiten diferentes colores cuando se queman. Niels Bohr propuso que los electrones solo pueden orbitar en niveles de energía específicos, y que cambian entre estos niveles al absorber o emitir radiación. Los números cuánticos como el principal, el orbital y el magnético definen estas órbitas y las propiedades de los átomos.