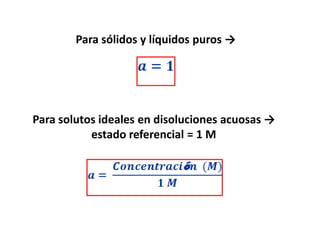
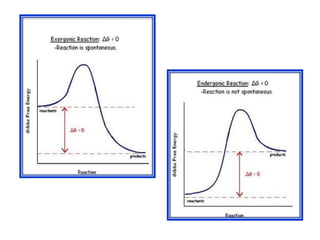
Este documento resume la ecuación de Gibbs y cómo se relaciona con la espontaneidad de las reacciones químicas. Explica que la variación de la energía libre de Gibbs (ΔG) determina si una reacción será espontánea o no, y que ΔG depende de factores como la temperatura, la constante de equilibrio K, y el cociente de reacción Q. También define conceptos clave como la actividad química y los estados de referencia para diferentes sustancias.