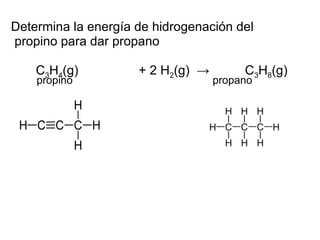
Este documento aplica la ley de Hess para determinar la energía de hidrogenación del propino para dar propano a partir de los datos de energía de otras reacciones relacionadas. Explica el proceso de invertir reacciones, multiplicarlas y sumarlas según la ley de Hess para calcular que la energía de hidrogenación del propino a propano es -289,6 kJ.
![TEMA 4 TERMO LEY DE HESS [email_address] José A. Martín](https://image.slidesharecdn.com/t4termoleydehess-091207131423-phpapp01/85/T4-Termo-Ley-De-Hess-1-320.jpg)








![TEMA 4 TERMO LEY DE HESS [email_address] José A. Martín](https://image.slidesharecdn.com/t4termoleydehess-091207131423-phpapp01/85/T4-Termo-Ley-De-Hess-11-320.jpg)