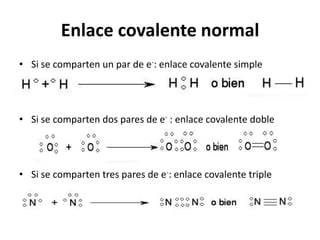
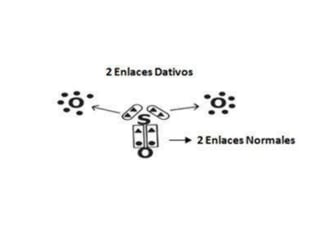
El documento describe los diferentes tipos de enlaces covalentes. Explica que los enlaces covalentes se forman por la compartición de electrones entre átomos no metálicos, y que pueden ser simples, dobles o triples dependiendo de la cantidad de pares de electrones compartidos. También distingue entre enlaces covalentes apolares y polares, y describe los enlaces covalentes dativos donde un átomo aporta el par de electrones compartidos.