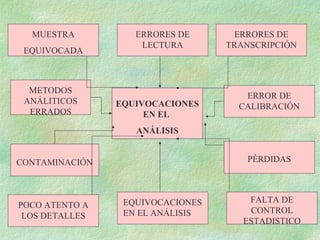
El documento describe diferentes tipos de errores que pueden ocurrir en el análisis químico, incluyendo errores instrumentales, de operación, del método y personales. También explica cómo los errores pueden ser constantes, proporcionales o aleatorios, y cómo se pueden detectar y eliminar los errores constantes a través de la calibración de instrumentos, análisis de muestras patrón y variando el tamaño de la muestra. Finalmente, señala que los errores aleatorios son más difíciles de detectar ya que