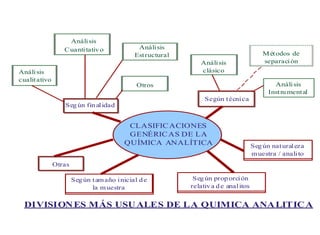
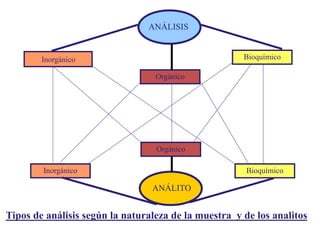
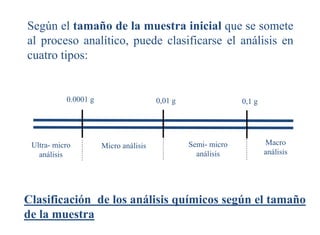
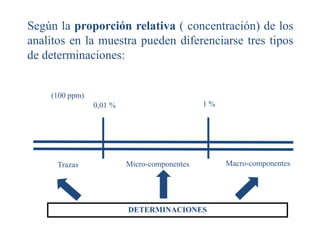
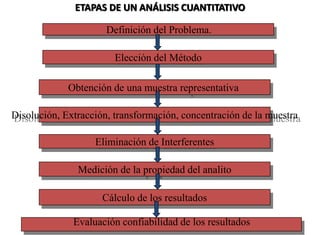
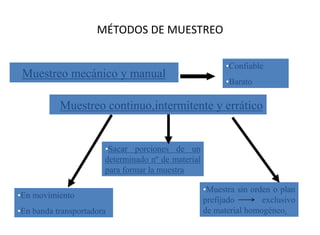
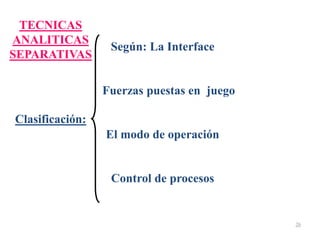
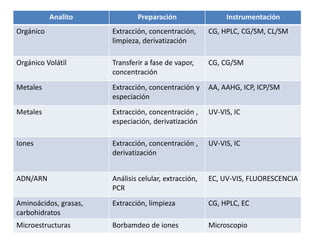
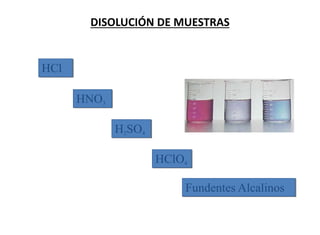
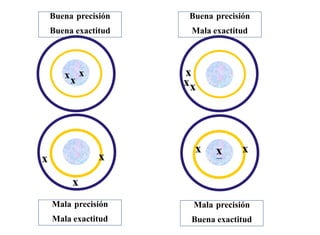
Este documento presenta una introducción a la química analítica. Explica que la química analítica estudia los principios y técnicas para determinar la composición química de las muestras, incluyendo análisis cualitativo y cuantitativo. También describe los diferentes tipos de análisis según la naturaleza de la muestra y el analito, así como los métodos utilizados como gravimétricos, volumétricos y espectroscópicos. Finalmente, resume las etapas clave de un an