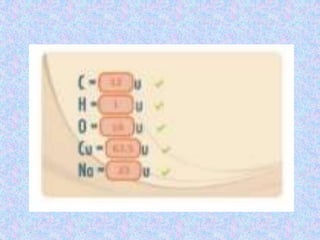
Este documento explica conceptos básicos de estequiometría como la conservación de la matería, el mol como unidad de cantidad de sustancia, la masa atómica como suma de protones y neutrones de un átomo, y la masa molecular como número que indica cuántas veces la masa de una molécula es mayor que la unidad de masa molecular. También define los términos mol, masa atómica, y masa molecular y cómo se calculan.