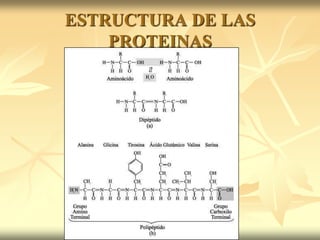
ESTRUCTURA DE LAS PROTEINAS.ppt
- 4. ESTRUCTURA SECUNDARIA La estructura secundaria o nivel secundario de organización estructural de las proteínas ha sido definida como la conformación presente en regiones locales del polipéptido o proteína, que esta estabilizada a través de enlaces de hidrogeno entre los elementos del enlace peptídico.
- 5. Las estructuras secundarias están mantenidas por enlaces de Hidrogeno entre diferentes grupos peptídico, específicamente entre el grupo N-H de un enlace peptídico y el grupo carbonilo (C=O) de otro enlace peptídico.
- 6. Pauling y Corey, al estudiar las posibles estructuras secundarias de las proteínas, describieron que las principales estructuras que forman parte de este nivel de organización, deben tener las siguientes características (Postulados de Pauling and Corey):
- 7. Los amino ácidos son de la serie L Los átomos del enlace peptídico están en un mismo plano y la configuración del enlace es trans Cada oxigeno carbonilito y cada nitrógeno amílico están formando puentes de Hidrogeno
- 8. La rotación solo es posible alrededor del carbono alfa. Los hidrógenos que forman parte de los puentes de hidrogeno se encuentran cercanos a la línea hipotética que une a los átomos de oxigeno y nitrógeno involucrados en el enlace peptídico La cadena lateral R de los aminoácidos no están involucradas en la estructura secundaria
- 9. El nivel secundario de organización de las proteínas incluye a las siguientes estructuras: Alfa-hélice Beta-lamina o estructura en hoja beta plegada
- 10. Beta-laminar
- 11. Alfa hélice Es el segundo nivel de organización proteica en el cual el esqueleto peptídico esta enrollado, como una estructura en espiral, alrededor de un eje imaginario, (organización helicoidal de la cadena peptídico)
- 12. Caracteristicas estructurales de la alfa- helice Hay 3.6 amino ácidos en cada vuelta de la hélice. Todos los enlaces peptídico son planares y trans. Los grupos N-H de todos los enlaces peptídico apuntan en la misma dirección, la cual es aproximadamente paralela al eje de la hélice Los grupos C=O de todos los enlaces peptídico apuntan en la dirección opuesta a la de los grupos NH, también casi paralela al eje de la hélice.
- 13. El grupo C=O de cada enlace peptídico esta unido por enlace de hidrogeno al grupo N-H del enlace peptídico que se encuentra separado de el por cuatro amino ácidos Todos los grupos R se encuentran dispuestos hacia afuera de la hélice.
- 14. La estabilidad de la alfa-hélice esta afectada por diversos factores que incluyen, entre los mas importantes: Las interacción electrostática entre aminoácidos sucesivos con cadenas R que contienen grupos cargados.
- 15. El tamaño de los grupos R adyacentes Las interacciones entre grupos R espaciados por tres o cuatro residuos La presencia de residuos de Prolina (recuérdese que la prolina es un iminoacido con una configuración diferente a la de los otros aminoácidos
- 16. Casi ¼ de todos los residuos de aminoácidos que forman un polipéptido forman parte de alfa-hélices, aunque este número es variable y puede variar grandemente de proteína a proteína.
- 17. Beta laminar La estructura secundaria se define como el nivel secundario de organización de las proteínas en el cual el esqueleto de la cadena peptídico (Beta hebras) se extiende en un arreglo en zigzag similar a una serie de pliegues, con los enlaces peptídico organizados en planos de inclinación alterna (alternando planos descendentes y planos ascendentes).
- 18. La hoja plegada beta puede formarse entre dos cadenas peptídicas o entre diferentes segmentos de una misma cadena peptídico.
- 19. Caracteristicas de la Hoja plegada (beta-lamina) Cada enlace peptídico es planar y tiene configuración trans. Los grupos C=O y N-H de los enlaces peptídico de cadenas adyacentes (o de segmentos adyacentes de una misma cadena) están en el mismo plano apuntando uno hacia el otro, de tal forma que se hace posible el enlace de hidrogeno entre ellos.
- 21. Los puentes de hidrogeno son mas o menos perpendiculares al eje principal de la estructura en hoja plegada. Todos los grupos R en cada una de las cadenas alternan, primero arriba del eje de la lamina, después abajo del mismo, y asi sucesivamente.
- 22. Hay dos clases de estructura beta en hoja plegada: Antiparalela: se forma cuando las dos cadenas polipeptídicas corren en dirección opuesta (una corre del grupo amino al carboxilo y la otra del carboxilo al amino)
- 24. ESTRUCTURA TERCIARIA Se llama estructura terciaria a la disposición tridimensional de todos los átomos que componen la proteína, concepto equiparable al de conformación absoluta en otras moléculas.
- 25. La estructura terciaria de una proteína es la responsable directa de sus propiedades biológicas, ya que la disposición espacial de los distintos grupos funcionales determina su interacción con los diversos ligandos
- 26. Para las proteínas que constan de una sola cadena polipeptídica (carecen de estructura cuaternaria), la estructura terciaria es la máxima información estructural que se puede obtener.
- 27. La estructura terciaria es una disposición precisa y única en el espacio, y surge a medida que se sintetiza la proteína. En otras palabras, la estructura terciaria está determinada por la secuencia de AA (estructura primaria)
- 28. Se distinguen dos tipos de estructura terciaria: Proteínas con estructura terciaria de tipo fibroso en las que una de las dimensiones es mucho mayor que las otras dos. Son ejemplos el colágeno, la queratina del cabello o la fibroína de la seda, En este caso, los elementos de estructura secundaria (hélices a u hojas b) pueden mantener su ordenamiento sin recurrir a grandes modificaciones, tan sólo introduciendo ligeras torsiones longitudinales, como en las hebras de una cuerda.
- 30. Proteínas con estructura terciaria de tipo globular, más frecuentes, en las que no existe una dimensión que predomine sobre las demás, y su forma es aproximadamente esférica. En este tipo de estructuras se suceden regiones con estructuras al azar, hélice a hoja b, acodamientos y estructuras súper secundarias. Ej. Mioglobina
- 32. Las fuerzas que estabilizan la estructura terciaria de una proteína se establecen entre las distintas cadenas laterales de los AA que la componen. Los enlaces propios de la estructura terciaria pueden ser de dos tipos: covalentes y no covalentes
- 33. Los enlaces covalentes pueden deberse a la formación de un puente disulfuro entre dos cadenas laterales de Cys, o a la formación de un enlace amida (-CO-NH-) Los enlaces no covalentes pueden ser de cuatro tipos: fuerzas electrostáticas entre cadenas laterales ionizadas, con cargas de signo opuesto, puentes de hidrógeno, entre las cadenas laterales de AA polares
- 34. Interacciones hidrofóbicas entre cadenas laterales apolares y fuerzas de polaridad debidas a interacciones dipolo-dipolo
- 35. ESTRUCTURA CUATERNARIA Como se mencionó anteriormente muchas proteínas tienen dos o más cadenas plegadas de polipéptidos para formar su estructura terciaria. En la estructura cuaternaria se consideran moléculas proteicas superiores a los 50 mil daltons en donde las subunidades constitutivas pueden ser idénticas o diferentes y se asocian para formar dímeros, trímeros y tetrámeros.
- 37. En algunos casos las cadenas aisladas son inactivas, pero en otros pueden cumplir la misma función que el complejo El ejemplo más conocido es la hemoglobina en donde las interacciones hidrofóbicas, los enlaces de hidrógeno y los enlaces iónicos ayudan a mantener las cuatro subunidades juntas para formar una molécula funcional,
- 38. Así cada subunidad de hemoglobina se pliega de manera similar a la estructura terciaria de mioglobina
- 40. Dado que la hemoglobina dentro de los glóbulos rojos está constituida por dos cadenas alfa y dos cadenas beta que permiten tomar una molécula de oxígeno, para "atrapar" moléculas adicionales de oxígeno, las cuatro subunidades cambian ligeramente su conformación y los enlaces iónicos se rompen para exponer las cadenas y facilitar esta función
- 41. Esto indica que las asociaciones estrechas de las cadenas de polipéptidos dentro de la misma proteína proporcionan un tipo de comunicación entre las unidades y se puede entender que en las cadenas de aminoácidos existen dos tipos de información: uno que genera la conformación adecuada de las estructuras secundarias, terciarias y cuaternarias y otro que permite la reactividad correcta de las moléculas.
- 42. Dominios Existen regiones diferenciadas dentro de la estructura terciaria de las proteínas que actúan como unidades autónomas de plegamiento y/o desnaturalización de las proteínas.
- 43. Estas regiones constituyen un nivel estructural intermedio entre las estructuras secundaria y terciaria reciben el nombre de dominios. Los dominios se pliegan por separado a medida que se sintetiza la cadena polipeptídica
- 44. Desnaturalización La pérdida total o parcial de los niveles de estructuración superiores al primario recibe el nombre de desnaturalización, que puede ser reversible o irreversible. Quedando la cadena polipeptídica reducida a un polímero estadístico sin ninguna estructura tridimensional fija.
- 46. La desaparición total o parcial de la envoltura acuosa, la neutralización de las cargas eléctricas de tipo repulsivo o la ruptura de los puentes de hidrógeno facilitará la agregación intermolecular y provocará la precipitación. La precipitación suele ser consecuencia del fenómeno llamado desnaturalización y se dice entonces que la proteína se encuentra desnaturalizada
- 47. Una proteína desnaturalizada cuenta únicamente con su estructura primaria
- 48. Por este motivo, en muchos casos, la desnaturalización es reversible Los agentes que provocan la desnaturalización de una proteína se llaman agentes desnaturalizantes. Se distinguen agentes físicos (calor) y químicos (detergentes, disolventes orgánicos, pH, fuerza iónica). Como en algunos casos el fenómeno de la desnaturalización es reversible
- 49. Gracias!!!!!!