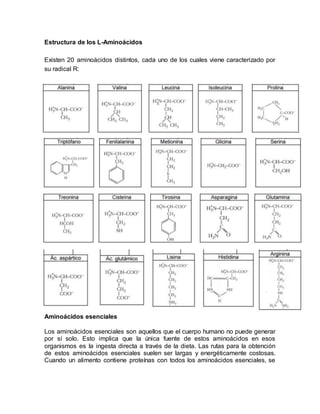
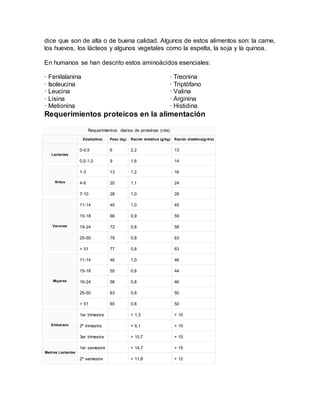
Los aminoácidos son las unidades básicas que forman las proteínas. Poseen un grupo amino, un grupo carboxilo y un carbono alfa. Las proteínas adoptan una estructura cuaternaria a través de la unión de cadenas polipeptídicas mediante enlaces débiles. La estructura cuaternaria modula la actividad biológica de la proteína.